Палитра люцифераз: природные инструменты для новых методов в биомедицине
- Авторы: Котлобай А.А.1, Каськова З.М.1,2, Ямпольский И.В.3,4
-
Учреждения:
- Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
- НИИ трансляционной медицины, Российский национальный исследовательский университет им. Н.И. Пирогова
- Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, НИИ трансляционной медицины
- Российский национальный исследовательский университет им. Н.И. Пирогова
- Выпуск: Том 12, № 2 (2020)
- Страницы: 15-27
- Раздел: Обзоры
- Дата подачи: 06.08.2020
- Дата публикации: 07.08.2020
- URL: https://actanaturae.ru/2075-8251/article/view/11152
- DOI: https://doi.org/10.32607/actanaturae.10967
- ID: 11152
Цитировать
Аннотация
Оптоаналитические методы, основанные на использовании генетически кодируемых биолюминесцентных люцифераз, обладают очень высокой чувствительностью, неинвазивны и не требуют возбуждающего излучения. Биолюминесценция основана на химической реакции окисления низкомолекулярного субстрата (люциферина) кислородом воздуха, катализируемой ферментом (люциферазой). Релаксация продукта окисления люциферина из возбужденного состояния сопровождается высвобождением кванта света, который может быть зарегистрирован как аналитический сигнал. Возможность экспрессии генов люцифераз в различных гетерологических системах и высокие квантовые выходы реакции люминесценции определяют популярность этих инструментов в биологии и медицине. Из нескольких десятков известных природных люцифераз некоторые нашли практическое применение. Размер люциферазы, длина волны максимума люминесценции, термостабильность фермента, рН-оптимум реакции, потребность в кофакторах – все эти параметры могут отличаться у люцифераз из различных групп организмов, что оказывает непосредственное влияние на выбор области применения каждого фермента. Современным исследователям важно проанализировать все многообразие доступных люцифераз и их биохимических свойств для выбора оптимальной биолюминесцентной метки, подходящей для решения конкретной задачи.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
BRET – Фёрстеровский резонансный перенос энергии излучения биолюминесценции;
CHO cells – клетки яичника китайского хомяка (клеточная линия);
DLSA – 5’O-[(N-дегидролюциферил)сульфамоил]аденозин;
GFP – зеленый флуоресцентный белок.
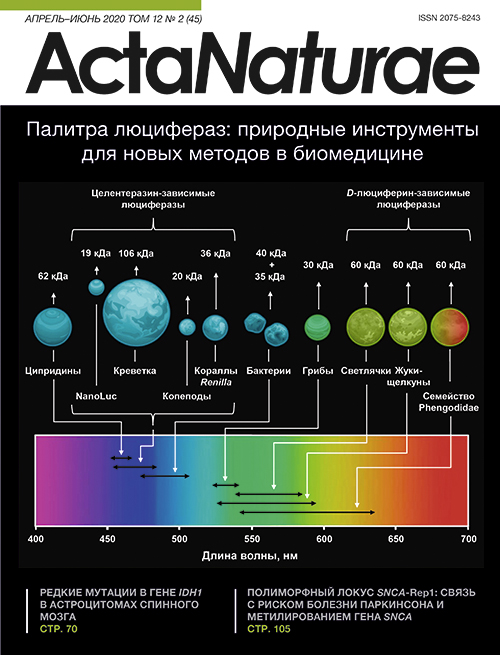
Современные биомедицинские исследования, например, высокопроизводительный скрининг лекарственных препаратов, детальные исследования механизмов развития заболеваний и разработка новых методов для персонализированной медицины, основаны на различных аналитических методиках, одной из которых является биоимиджинг. Для биоимиджинга, или визуализации происходящих в организме процессов неинвазивным способом в режиме реального времени, современная наука и медицина используют широкий спектр физико-химических методов [1]. Методы оптического биоимиджинга, основанные на генетически кодируемых инструментах, таких, как флуоресцентные белки и биолюминесцентные люциферазы (рис. 1), позволяют получать высокочувствительные (вплоть до уровня отдельной клетки) и точные аналитические сигналы из живых тканей и организмов [2]. Биолюминесцентные методы имеют ряд преимуществ перед флуоресцентными, таких, как отсутствие необходимости возбуждающего излучения, зачастую токсичного для живых клеток, и помех от рассеяния света и автофлуоресценции, что приводит к более высокой чувствительности. Кроме того, в случае люцифераз отсутствует явление «выгорания», присущее флуоресцентным меткам. Также биолюминесценция обеспечивает хорошее пространственное разрешение и простую количественную оценку сигнала.
Рис. 1. Основные свойства природных люцифераз. Представлены сред- ние размеры и спектральные характеристики природных люцифераз из различных организмов и NanoLuc
Биолюминесценция, или свечение живых организмов, основана на катализируемой ферментом-люциферазой реакции окисления низкомолекулярного субстрата-люциферина молекулой кислорода. Из приблизительно 40 различных существующих механизмов биолюминесценции только 10 были изучены в различной степени глубины. Пять из них (рис. 2) уже нашли применение в многочисленных аналитических методах. Основная цель данного обзора – описать разнообразие и особенности природных люцифераз, которые могут быть использованы для разработки новых биоимиджинговых и аналитических методов в биомедицине.
Рис. 2. Механизмы биолюминесценции
2.1 Structure of D-luciferin and mechanism of its bioluminescence.
2.2 Reaction of coelenterazine bioluminescence.
2.3 Structure of cypridinid luciferin and its bioluminescence reaction.
2.4 Scheme of bacterial bioluminescence. RCHO – bacterial luciferin (dodecanal); RCOOH – bacterial luciferin oxidation product; FMNH2 – flavin mononucleotide (riboflavin-5′-phosphate) reduced form (cofactor); FMN-OH – FMN-4a-hydroxide, light-emitting substance; FMN - flavin mononucleotide oxidized form.
2.5 Scheme of fungal bioluminescence starting from caffeic (3,4-dihydroxycinnamic) acid
Формат обзора не позволяет рассмотреть всю палитру теоретически доступных для практического использования природных люцифераз. Существует ряд достаточно хорошо изученных механизмов биолюминесценции, применение которых все еще довольно ограничено. Например, для фотопротеинов, в которых молекула субстрата в активированной форме (2-гидропероксицелентеразин) нековалентно связана с гидрофобной полостью белка [3], характерно излучение синего света быстрой вспышкой, а на регенерацию субстрат-ферментного комплекса может уйти до нескольких часов [4]. Наряду с зависимостью биолюминесценции от концентрации ионов кальция, это является существенным недостатком фотопротеинов. Перспективы использования люцифераз биолюминесцентных систем морской полихеты Odontosyllis и динофлагеллят также ограничены, так как их люциферины малостабильны и до сих пор недоступны синтетически [5, 6].
Методы биомедицинских исследований, основанные на люциферин-люциферазных реакциях, играют существенную роль в современной науке. Спектр их применения огромен: от аналитических методов in vitro и in vivo до биоимиджинга живых систем в режиме реального времени [2]. Однако наличие некоторых недостатков ограничивает применение люцифераз и стимулирует дальнейшее изучение природных биолюминесцентных систем с целью поиска новых люциферинов и люцифераз для расширения спектра методов и улучшения уже существующих инструментов анализа.
1. D-ЛЮЦИФЕРИН-ЗАВИСИМЫЕ ЛЮЦИФЕРАЗЫ
Светящиеся виды представлены в четырех отрядах насекомых: полужесткокрылых (Hemiptera), жесткокрылых (Coleoptera), двукрылых (Diptera) и у ногохвосток (Collembola). Тем не менее, текущие биохимические и молекулярные исследования в основном сосредоточены на представителях отрядов жесткокрылых и двукрылых. Биолюминесценция двукрылых, в отличие от жесткокрылых, изучена очень слабо. Отряд жесткокрылых включает три семейства, в которых встречаются биолюминесцентные виды: светлячки (Lampyridae), жуки-щелкуны (Elateridae) и железнодорожные черви (Phengodidae). Биолюминесцентные системы всех исследованных видов жесткокрылых используют один и тот же субстрат, D-люциферин, впервые обнаруженный у светлячков. Реакция биолюминесценции светлячка проходит в два этапа: аденилирование D-люциферина и окисление аденилата люциферина (рис. 2.1). Для аденилирования необходимо участие кофакторов ATP и Mg2+.
1.1 Люциферазы светлячков
К настоящему времени известны гены, кодирующие различные люциферазы светлячков. Как правило, люциферазы светлячка представляют собой мономерные эуглобулины массой 60 кДа, имеющие склонность к димеризации в концентрированных растворах [7]. Аминокислотные последовательности светлячковых люцифераз из разных видов имеют около 60–80% идентичности [8]. Также на поверхности люциферазы находятся два независимых сайта связывания ATP и D-люциферина и сайт связывания аденилата люциферина [9].
Впервые кристаллическая структура люциферазы светлячка в свободной форме была получена в 1996 году [10]. За последние десятилетия изучены также кристаллические структуры люциферазы, находящейся на различных каталитических стадиях: аденилатобразующей (в комплексе с DLSA), окислительной (с аденилатом люциферина) и постреакционной (в комплексе с АМР/оксилюциферином) [11, 12]. Полученные структуры подтверждают роль люциферазы в определении цвета биолюминесценции и дают представление о химическом механизме стадии окисления. Эти данные стимулировали подробные исследования фермента, что привело к большому притоку новой структурной информации, по объему превосходящей все полученное для любой другой люциферазы. Как видно на рис. 3, фермент состоит из двух глобулярных доменов: большего N-концевого и меньшего C-концевого, включающего в себя также сигнальную последовательность локализации в пероксисомах. Третичную структуру белка формируют два β-слоя, имеющие по краям α-спирали и составляющие вместе αβαβα-мотив и β-бочонок. Активный сайт фермента образован поверхностями N- и C-концевых доменов, обращенными друг к другу. Во время биолюминесцентной реакции светлячковая люцифераза претерпевает значительные конформационные изменения, и N- и C-концевые домены достаточно сильно сближаются для позиционирования субстратов [10]. Доказано, что С-концевой домен определяет активность люциферазы светлячка (удаление последних 12 аминокислот приводит к полной утрате биолюминесценции) [13]. Также найдены сайты связывания D-люциферина [14]. Полученная информация привела к разработке и успешному применению генетически модифицированных люцифераз с улучшенными свойствами.
Рис. 3. Кристаллическая структура люциферазы P. pyralis дикого типа в аденилатобразующей стадии в комплексе с DLSA
Квантовый выход биолюминесценции светлячка впервые был оценен Seliger H.H. и McElroy W.D. в 1960 году и составил 88 ± 25% [15]. Позже квантовый выход биолюминесценции P. pyralis был пересчитан Ando Y. и соавт.: 41.0 ± 7.4% при рН 8.5 и уменьшается при понижении рН [16].
Также изучено влияние двухвалентных ионов на биолюминесценцию светлячка [17]. Показано, что увеличение концентрации ионов Mn2+, Ca2+ или Mg2+ не влияет на квантовый выход или цвет излучения, в то время как присутствие ионов Zn2+, Cd2+, Fe2+, Ni2+ и Co2+ вызывает батохромный сдвиг [17, 18]. Квантовый выход реакции наиболее чувствителен к ионам Hg2+: при увеличении их концентрации он резко уменьшается.
Один из параметров, наиболее важных для практического применения люциферазы, – длина волны максимума биолюминесценции. У различных видов светлячков и других организмов, использующих D-люциферин, природный максимум эмиссии варьирует от зеленого (534 нм) до красного (638 нм) [8]. Показано, что цвет биолюминесценции светлячковых люцифераз претерпевает батохромный сдвиг при снижении рН [15, 16], повышении температуры или в присутствии в растворе ионов двухвалентных металлов [17, 18]. В то же время у люцифераз других семейств отряда цвет биолюминесценции в экспериментах in vitro не зависит от упомянутых условий проведения реакции [17, 19].
Несмотря на активное изучение механизма регуляции цвета биолюминесценции, вопросы химической основы данного процесса и специфических взаимодействий в активном центре так и остаются не до конца решенными. Очевидно, что цвет биолюминесценции зависит от двух основных факторов: структуры светоизлучателя и аминокислотных остатков активного центра люциферазы, образующих его микроокружение. Согласно различным исследованиям одна из гипотез состоит в том, что цвет свечения природных светлячковых люцифераз определяется конформацией активного сайта, косвенно влияющей на полярность и специфические взаимодействия вокруг оксилюциферина [20]. Закрытая неполярная конформация соответствует зеленому излучению, а открытая и/или более полярная конформация приводят к красному свету люминесценции [21, 22].
В настоящее время доступны различные стабильные мутантные формы светлячковой и других люцифераз жесткокрылых с цветами биолюминесценции, находящимися в желто-зеленом, красном и даже ближнем инфракрасном диапазоне. Альтернативным подходом к изменению цвета люминесценции является модификация D-люциферина. На сегодняшний день разработан широкий спектр аналогов D-люциферина, приводящих к спектральному сдвигу люминесценции люцифераз жесткокрылых, в том числе в ближний инфракрасный диапазон длин волн [23–25].
Другой фактор, который следует учитывать при разработке новых применений природных люцифераз – ограниченный диапазон их термостабильности. Большинство этих ферментов инактивируется даже при умеренных температурах (30°C), и это играет решающую роль для in vivo применений. Еще один важный параметр, который надо учесть, например, для микроскопии, – это яркость реакции биолюминесценции, которая, в свою очередь, является функцией квантового выхода, Km, Vmax, скорости оборотов фермента, стабильности белка и чувствительности к ингибированию продуктом [26]. Для преодоления недостатков природных ферментов методами сайт-направленного мутагенеза получено несколько более ярких и термостабильных аналогов люцифераз светлячка [27].
Таким образом, некоторые свойства люцифераз светлячка, такие, как высокий квантовый выход, разнообразная цветовая палитра биолюминесценции и уникальный механизм ее цветовой изменчивости, делают эти ферменты очень эффективным инструментом для биотехнологии. С другой стороны, в некоторых случаях недостатком могут стать незаменимость кофакторов (ATP, Mg2+) и чувствительность спектров биолюминесценции к рН, ионам двухвалентных металлов и повышенной температуре. Однако в настоящее время, несмотря на все ограничения, система биолюминесценции светлячков широко используется во многих отраслях науки, и ее практический потенциал еще не исчерпан. Разработанные химерные конструкции, термостабильные, хеморезистентные люциферазы, а также люциферазы с укороченным внутриклеточным периодом полувыведения на основе светлячковой люциферазы описаны в соответствующих обзорах [28, 29].
1.2 Люциферазы жуков-щелкунов
Биолюминесцентная система жуков-щелкунов, в которой в роли субстрата также выступает D-люциферин, изучена достаточно хорошо. Несколько люцифераз из разных видов семейства Elateridae были идентифицированы, клонированы и охарактеризованы. Это белки с молекулярной массой около 60 кДа. Биолюминесценция жуков-щелкунов находится в диапазоне от 532 до 593 нм [30], однако этот параметр может варьировать даже у насекомых одного вида, обитающих в разных популяциях [31].
Первой среди представителей семейства Elateridae была изучена биолюминесцентная система ямайского Pyrophorus plagiophthalamus. Из одного организма (пятен на голове и светящегося органа на брюшке) были клонированы четыре типа люцифераз с разными цветами биолюминесценции: зеленая (546 нм), желто-зеленая (560 нм), желтая (578 нм) и оранжевая (593 нм) [32]. По кДНК, кодирующим эти четыре люциферазы, выявлена высокая степень гомологии между белками (от 95 до 99%), в то время как гомология с люциферазой светлячка оказалась намного меньше (около 47%) [32, 33]. Как и светлячковая люцифераза, данные ферменты содержат на С-конце сигнальную последовательность локализации в пероксисомах.
Цветовое разнообразие и нечувствительность люцифераз жуков-щелкунов к изменению pH в пределах физиологического диапазона (от шести до восьми) делают их весьма привлекательными для разработки аналитических методов in vivo. Зеленые и красные формы люциферазы P. plagiophthalamus и их гены коммерчески доступны (CBG – зеленая форма и CBR – красная). Кроме того, эти люциферазы самые маленькие среди всех люцифераз насекомых (около 543 аминокислотных остатков). Однако они склонны к агрегации и образованию активных димеров в концентрированных растворах [9], и это следует учитывать перед планированием экспериментов in vivo.
Увеличение интенсивности сигнала биолюминесценции люцифераз жуков-щелкунов изучается несколькими научными группами. Так, для биоимиджинга получен в 10 раз более яркий мутант, чем люцифераза светлячка [34]. Влияние аминокислотного состава на цвет биолюминесценции люцифераз жуков-щелкунов изучено Viviani V.R. с соавт. [35].
1.3 Люциферазы железнодорожных червей
На настоящий момент клонированы и изучены люциферазы только четырех видов железнодорожных червей (Phengodidae). Лучше всего исследована биолюминесценция Phrixothrix vivianii. Представители этого вида содержат две люциферазы с существенно различными цветами биолюминесценции: λmax = 542 нм (желто-зеленая) и λmax = 620 нм (красная) [36, 37]. В то же время биолюминесценция P. hirtus самая «длинноволновая» (λmax = 636 нм) среди всех жесткокрылых [37].
Биохимические свойства люцифераз железнодорожных червей изучены довольно слабо. Как и у люцифераз жуков-щелкунов, спектр их биолюминесценции нечувствителен к pH [19, 38]. Две люциферазы P. vivianii (PvGR (542 нм) и PhRE (622 нм)) были клонированы [37]. Молекулярная масса каждой составляет около 60 кДа. Их аминокислотные последовательности имеют довольно высокую степень гомологии друг с другом (71%) и с соответствующими люциферазами японского железнодорожного червя Rhagophthalmus ohbai (66.6% для PvGR и 56% для PhRE), что характерно для родственных видов [39]. Тем не менее, гомология PvGR и PhRE с люциферазами Lampyridae (50–55 и 46–49% соответственно) и Elateridae (47–49%) ниже, и указывает на их независимое эволюционное развитие [37]. Последовательности люцифераз железнодорожных червей также содержат на С-конце трипептид, отвечающий за локализацию в пероксисомах [7].
2. ЦЕЛЕНТЕРАЗИН-ЗАВИСИМЫЕ ЛЮЦИФЕРАЗЫ
Морские организмы составляют значительную часть всех известных светящихся видов. Биолюминесцентным субстратом для большинства из них является целентеразин (рис. 2.2) [40]: в том числе кораллов (Renilla), веслоногих ракообразных (Copepoda), ракушковых ракообразных (Conchoecia), головоногих моллюсков (Vampyroteuthis), сцифоидных медуз (Periphylla), десятиногих ракообразных (Oplophorus) и др.
Все целентеразин-зависимые люциферазы можно разделить на две группы. К первой относятся истинные люциферазы, катализирующие классическую люциферин-люциферазную реакцию, в результате которой образуется оксилюциферин, излучающий квант света (рис. 2.2). Вторая включает фотопротеины – биолюминесцентные белки, которые в данном обзоре не рассматриваются.
2.1 Люциферазы кораллов Renilla
В настоящее время известны последовательности люцифераз Renilla reniformis и R. muelleri (RLuc) [41]. Масса люциферазы R. reniformis составляет 36 кДа. RLuc – единственная среди всех целентеразин-зависимых внутриклеточная люцифераза. Для биолюминесценции Renilla помимо люциферазы, целентеразина и кислорода необходимы еще два белка: целентеразин-связывающий белок (CBP) и зеленый флуоресцентный белок (GFP) [42, 43]. Люцифераза может катализировать люминесценцию целентеразина in vitro и без дополнительных белков, но в присутствии GFP реакция протекает с более высоким квантовым выходом. Также экспериментально показано образование комплекса RLuc–GFP [43]. Максимум люминесценции в этом случае смещается в длинноволновую область (от 480 к 509 нм) вследствие Фёрстеровского резонансного переноса энергии биолюминесценции (BRET).
RLuc не гомологична другим целентеразин-зависимым ферментам, известным на данный момент, однако высокий процент гомологии наблюдается между RLuc и белками семейства α/β-гидролаз [44]. Эти данные получены на основе изучения пространственной структуры люциферазы Renilla [45] (рис. 4).
Рис. 4. Структура люциферазы R. reniformis
Природная RLuc по биохимическим свойствам подходит для различных аналитических применений. Температурный оптимум активности фермента составляет 18–37°С, оптимум рН от 6.0 до 7.0, но квантовый выход реакции биолюминесценции у нее относительно низкий (5.3%) [46]. Благодаря своим свойствам люцифераза RLuc наиболее предпочтительна как биолюминесцентный репортер для исследований, проводимых в культурах клеток, и анализов in vitro. Синий цвет и низкий квантовый выход биолюминесценции ограничивают ее использование в экспериментах in vivo [44], поскольку животные ткани сильно поглощают видимый свет за пределами «окна прозрачности» (600–900 нм). Для преодоления различных ограничений методами случайного или сайт-направленного мутагенеза получен ряд репортеров на основе RLuc с улучшенными свойствами: повышенной устойчивостью к инактивации сывороткой крови, повышенной яркостью, а также белки со спектрами, смещенными в длинноволновую область [44, 47–49]. Чтобы расширить сферу применения RLuc, разработаны более яркие аналоги целентеразина с красным спектром люминесценции [49, 50].
2.2 Люциферазы веслоногих ракообразных Copepoda
На данный момент известно 28 последовательностей люцифераз, принадлежащих к 12 различным видам подкласса веслоногих ракообразных (копепод). Некоторые из них имеют несколько генов, кодирующих до трех изоформ белка. Интересно, что гомология между изоформами люциферазы одного вида копепод сравнима с гомологией между люциферазами разных, часто таксономически удаленных видов [51]. Несмотря на то что люциферазы веслоногих ракообразных широко используются в различных исследованиях как in vitro [52, 53], так и in vivo [54, 55], их нативная структура до сих пор неизвестна.
Первыми были клонированы люциферазы Gaussia princeps (GLuc) [56] и Metridia longa (MLuc) [55]. Это небольшие секретируемые белки с молекулярной массой около 20 кДа. Люцифераза копепод состоит из сигнального пептида, необходимого для секреции, вариабельного N-концевого и консервативного С-концевого доменов. По-видимому, вариабельный домен не имеет прямого отношения к биолюминесцентной функции фермента, более того, его отсутствие увеличивает скорость реакции биолюминесценции. Так, мутантные формы MLuc обладают примерно в 1.5–3 раза большей люминесцентной активностью, чем полноразмерные люциферазы [57]. Консервативный домен люциферазы копепод состоит из двух неидентичных тандемных повторов по 70 аминокислот, каждый из которых содержит высококонсервативный фрагмент из 32 аминокислот [55, 58]. Данные о влиянии этих повторов на биолюминесцентную активность очень противоречивы. Согласно некоторым, при экспрессии одного из тандемных повторов в Escherichia сoli проявлялась биолюминесцентная активность [58], однако это не подтвердилось в аналогичных экспериментах в эукариотических системах [59].
В целом, экспрессия генов люцифераз копепод в E. сoli довольно проблематична из-за значительной агрегации рекомбинантного белка, приводящей к гетерогенности конечного образца [52, 60]. Кроме того, люциферазы копепод содержат до пяти дисульфидных связей, а окислительно-восстановительный потенциал в цитоплазме бактериальных клеток не способствует их образованию. Поэтому биолюминесцентная активность рекомбинантных люцифераз, продуцируемых в бактериях, в несколько раз ниже активности тех же люцифераз, наработанных с использованием клеток насекомых [60–62]. Сравнительно недавно путем рефолдинга из телец включения E. coli впервые был получен высокоактивный мономерный белок MLuc (изоформа MLuc7) [63]. При использовании секретируемой формы люциферазы с последовательностью KDEL на С-конце (сигнал, удерживающий белок в эндоплазматическом ретикулуме) интенсивность биолюминесценции в клетке значительно увеличивается [54].
Природные люциферазы веслоногих ракообразных чрезвычайно термостабильны [64]. Даже после кипячения в течение 1 ч изоформа MLuc7 теряет только 50% активности [61]. Люциферин-люциферазная реакция копепод имеет более высокую скорость, чем у других целентеразин-зависимых люцифераз [52, 54, 57], и это может быть проблематичным для некоторых аналитических методов. Однако, поскольку реакция биолюминесценции копепод сильно зависит от состава буфера, ее скорость можно снизить путем добавления в реакционную смесь детергентов [65], хотя это и невозможно в экспериментах in vivo.
Природные люциферазы веслоногих ракообразных, как секретируемые белки, проявляют наибольшую эффективность в исследованиях внеклеточных процессов, межклеточных взаимодействий и в биоимиджинге живых тканей или небольших лабораторных животных. Доказана линейная корреляция между интенсивностью сигнала биолюминесценции в культуральной среде и количеством клеток, секретирующих репортерные белки GLuc [54, 66] и MLuc [67]. Поэтому эти люциферазы часто используют при изучении функционального состояния злокачественных опухолей: путем оценки уровня биолюминесцентной активности в образцах крови можно измерить скорость роста и метастазирования, а также реакцию опухолей на терапию [66, 67]. Другие традиционные способы применения люцифераз копепод описаны в обзоре [68].
Небольшой размер, стабильность и высокая интенсивность биолюминесценции люцифераз веслоногих ракообразных стимулируют разработку их новых применений [69]. Секретируемость позволяет использовать их для мониторинга биологических процессов ex vivo в клеточных средах, крови или моче животных в режиме реального времени. Созданы мутантные формы GLuc, которые обладают в 10 раз большей интенсивностью люминесценции, чем люциферазы дикого типа [70], пониженной кинетикой реакции [65], а также новые миниатюрные (16.5 кДа) [61], психрофильные и термостабильные [71] изоформы MLuc. Эти белки открывают новые возможности применения люцифераз в аналитических методах. Между тем, гашение и поглощение синего света in vivo в совокупности с быстрой кинетикой реакции природных люцифераз затрудняют их использование.
2.3 Люцифераза креветки Oplophorus gracilirostris
Первые образцы целентеразин-зависимой люциферазы O. gracilirostris (OLuc) были охарактеризованы в 1976 году [72]. Молекулярная масса OLuc составляет около 106 кДа [73]. Биолюминесценция Oplophorus имеет максимум 454 нм, а ее яркость сильно зависит от температуры, рН и концентрации соли. Температурный оптимум реакции лежит около 40°С, а оптимум рН 9 (люцифераза теряет активность при кислых значениях рН). Молекула OLuc состоит из четырех субъединиц: две по 19 кДа и две по 35 кДа. Люминесцентной активностью обладает только малая субъединица, но значительно более низкой, чем у природной люциферазы [74]. Это указывает на то, что бóльшая субъединица несет функцию стабилизации каталитического фрагмента в природном ферменте.
Путем компьютерного моделирования вторичной и третичной структуры белков и белковых доменов показано родство люциферазы Oplophorus с группой мембранных липидсвязывающих белков. Полученные данные позволили путем замены только одной аминокислоты в положении 166 разработать мутантную форму малой белковой субъединицы, в 3 раза более активную и в 1.5 раза более стабильную по сравнению с OLuc [75]. После трех раундов случайного мутагенеза этот мутант был доработан в форму под названием NanoLuc® (NLuc). Термостабильный мутант NLuc содержит 16 аминокислотных замен и имеет существенно улучшенные характеристики по сравнению с белком дикого типа. Яркость реакции биолюминесценции NLuc с фуримазином (аналогом целентеразина) в лизатах клеток НЕК293 в 2.5 млн раз выше, чем реакции между 19 кДа субъединицей люциферазы с целентеразином в тех же условиях, и в 150 раз выше, чем у люциферазы светлячка или Renilla в аналогичных условиях [75]. Однако следует отметить, что в аналогичных экспериментах с лизатами клеток E. coli и СНО увеличение биолюминесцентной активности NLuc было значительно менее существенным [76].
3. ЛЮЦИФЕРАЗЫ РАКУШКОВЫХ РАКООБРАЗНЫХ Cypridina
Уникальная биолюминесцентная система, основанная не на целентеразине, а на люциферине отличного строения, найдена у ракушковых ракообразных рода Cypridina. Структура люциферина Cypridina (Vargula) hilgendorfii определена в 1966 году [77] (рис. 2.3). Для реакции биолюминесценции ципридин необходимы три компонента: люциферин, кислород и люцифераза [78]. В отличие от Cypridina, светящиеся виды из других семейств класса Ostracoda, например Halocypridoidae и Conchoecia, имеют целентеразин-зависимые люциферазы, что, вероятно, связано с тем, что их люциферазы несекретируемые [79].
Люциферазу C. hilgendorfii клонировали в 1989 году [80], а успешное клонирование люциферазы C. noctiluca осуществили намного позже, в начале 2000-х годов [81]. Люциферазы Cypridina (CLuc) – это секретируемые белки с молекулярной массой около 62 кДа (одни из самых больших люцифераз), не имеющие значимой гомологии с другими, известными на данный момент люциферазами. Однако сравнение аминокислотных последовательностей двух люцифераз Cypridina показало высокую степень их гомологии между собой (около 84%). Тем не менее, при экспериментах с эукариотическими клеточными культурами активность люциферазы C. noctiluca была намного выше, чем у C. hilgendorfii [81]. Максимум биолюминесценции Cypridina находится в диапазоне 448–463 нм, реакция имеет довольно высокий квантовый выход (0.31) [82]. Спектр биолюминесценции зависит от ионной силы раствора, практически не зависит от рН, а температурный оптимум реакции равен 30°С. Реакция, катализируемая CLuc, сильно ингибируется добавлением EDТА, что, вероятно, указывает на участие в процессе ионов двухвалентных металлов, таких, как кальций и магний. Наличие 16 дисульфидных связей в CLuc делает практически невозможной функциональную экспрессию их генов в прокариотических системах. Однако недавно была показана возможность их продукции в культурах растительных клеток [83], но наличие двух сайтов N-гликозилирования в структуре белка может влиять на его свойства при экспрессии гена в эукариотах [83, 84].
Таким образом, люциферазы Cypridina очень стабильны, выдерживают длительное хранение при комнатной температуре и имеют один из самых высоких квантовых выходов среди всех известных люцифераз. Кроме того, это секретируемые белки, в результате чего они тоже подходят для анализа внутриклеточных процессов ex vivo. Однако крайняя нестабильность люциферина Cypridina и его высокая стоимость представляют серьезное препятствие для широкого применения данной биолюминесцентной системы.
4. ЛЮЦИФЕРАЗЫ БАКТЕРИЙ
Первые свидетельства излучения света живыми бактериями были зафиксированы Harvey E.N. в начале 1920-х годов (см. [85]). В дальнейшем показали, что для биолюминесценции бактерий необходим ряд компонентов, а именно: FMNH2, алифатический альдегид, люцифераза и кислород. Хотя бактериальный люциферин – додеканаль, который окисляется в ходе реакции биолюминесценции (рис. 2.4), истинным источником света является не он, а связанный с люциферазой гидроксифлавин. Додеканаль можно заменить in vitro на другие длинноцепочечные алифатические альдегиды [86]. Максимум биолюминесценции большинства штаммов бактерий in vitro находится в диапазоне 472–505 нм.
На данный момент лучше всего изучены биолюминесцентные системы Vibrio harveyi, V. fischeri, Photorhabdus (Xenorhabdus) luminescens, Photobacterium phosphoreum и P. leiognathi [85]. Все известные в настоящее время бактериальные люциферазы имеют одинаковую структуру: это гетеродимерные комплексы, состоящие из двух субъединиц – α-субъединицы с молекулярной массой 40 кДа и β-субъединицы с молекулярной массой 35 кДа. Показано, что активный центр фермента находится в α-субъединице [87]. Каждая субъединица кодируется отдельным геном – luxA и luxB соответственно. Впервые эти гены были клонированы в конце двадцатого века [88, 89]. По отдельности люциферазные субъединицы активности не проявляют, и простое смешивание растворов, их содержащих, ее не восстанавливает [90]. Однако совместная ренатурация обоих рекомбинантных полипептидов воссоздает активность [91].
Пространственная структура люциферазы V. harveyi была определена методом рентгеноструктурного анализа после получения ее кристалла (рис. 5) [92, 93]. Обе субъединицы имеют схожее строение: у каждой есть один домен, содержащий мотив β/α-бочонка. Фрагмент полипептидной цепи α-субъединицы от остатка фенилаланина 272 до треонина 288 образует подвижную петлю, которая изменяет конформацию при связывании с FMNH2 и защищает его от неспецифических взаимодействий [94]. Кроме того, консервативные остатки гистидина 44, аспарагиновой кислоты 113 и аргинина 107 в α-субъединице имеют решающее значение для связывания FMNH2 и высокого квантового выхода реакции [87, 93, 95, 96]. В то же время в люциферазе не обнаружен домен, характерный почти для всех флавинсвязывающих ферментов и содержащий подобную структуру β/α-бочонка. Это, вероятно, объясняется тем, что белок использует FMNH2 в качестве субстрата, а не простетической группы [97].
Рис. 5. Структура бактериальной люциферазы из V. harveyi
Люциферазы из P. phosphoreum и V. fischeri активны в широком диапазоне рН от 6.0 до 8.0 [98, 99]. Биохимические свойства бактериальных люцифераз могут быть значительно улучшены в мутантных формах. Например, люцифераза V. fischeri стабильна при 30°С, однако ее активность пропадает при 37°С [100]. Люцифераза V. harveyi, напротив, стабильна при 37°С. Сейчас чаще всего для визуализации бактерий используется люцифераза из P. luminescens, поскольку она остается стабильной до 42°C [101].
Главным преимуществом системы биолюминесценции бактерий является возможность полностью закодировать ее в lux-опероне. Оперон luxCDABE кодирует люциферазу (luxA и luxB) и белки, необходимые для синтеза субстрата (редуктазу, трансферазу и синтетазу – luxCDE) [102]. На данный момент известны структуры множества lux-оперонов, и каждый из них может быть использован в биотехнологии. В основном, lux-оперон применяется в прокариотических клетках для создания биосенсоров (как репортерный ген), для изучения развития бактериальных заболеваний и анализа экотоксичности. С помощью бактериального оперона биолюминесценция была успешно перенесена в несветящиеся штаммы, такие, как E. coli, Pseudomonas aeruginosa, Salmonella typhimurium, Listeria monocytogenes, Staphylococcus aureus, Streptococcus pneumoniae и др. [103–107]. Интересно, что также удалось получить светящиеся виды анаэробных бактерий Clostridium perfringens и Bifidobacterium breve, сигнал биолюминесценции которых обнаруживается в кишечнике подопытных животных в условиях низкого содержания кислорода [108, 109].
Гены lux-оперона были оптимизированы и для эукариотических клеток [110], в частности, клеток млекопитающих [111], несмотря на то, что большой размер оперона, невысокая яркость люминесценции и цитотоксичность бактериального люциферина затрудняют его внедрение в гетерологичных системах. Недавно благодаря внесению дополнительных изменений в оперон и настройке оптимальной экспрессии генов была разработана новая кассета «co Lux», яркость люминесценции которой в клетках HEK293 сравнима с яркостью светлячковой люциферазы [112]. Токсическое действие алифатического альдегида при использовании «co Lux» не наблюдается.
5. ЛЮЦИФЕРАЗЫ ВЫСШИХ ГРИБОВ
Несмотря на то что первые исследования свечения грибов начались в 17 веке, структура люциферина была определена только пять лет назад [113]. Биолюминесценция грибов основана на люциферине, относящимся к подклассу стирилпиронов класса поликетидов. Биосинтез люциферина осуществляется в две стадии из распространенного метаболита – кофейной кислоты (рис. 2.5). Недавно клонированы люциферазы нескольких видов высших грибов, а люциферазу Neonothopanus nambi (nnLuz) успешно использовали в различных имиджинговых экспериментах [114]. Люцифераза nnLuz состоит из 267 аминокислотных остатков, имеет молекулярную массу около 28.5 кДа. Оптимальными условиями для рекомбинантной люциферазы являются pH около 8.0 и температура не более 30°C. Экспрессируемая в клетках Pichia pastoris nnLuz была ассоциирована с микросомальной фракцией и излучала зеленый свет с максимумом при 520 нм (спектр идентичен спектру у мицелия N. nambi). Ген nnLuz успешно применяли в качестве репортерного в гетерологических системах P. pastoris, эмбрионов Xenopus laevis и клетках человека, а также для биоимиджинга опухолевых ксенотрансплантатов в живых мышах в режиме реального времени. Гены nnLuz и трех других ферментов, участвующих в биосинтетическом каскаде люциферина, входят в состав кластера, общего для биолюминесцентных грибов разных видов. Показано, что введение nnLuz вместе с генами биосинтеза люциферина грибов в геномы хозяев позволяет получить автономно светящиеся дрожжевые клетки и даже целые растения [115]. Структура люциферина грибов допускает простую схему его синтеза и позволяет легко ее варьировать для разработки новых аналогов с улучшенными спектральными характеристиками [116].
ЗАКЛЮЧЕНИЕ
Широкая палитра клонированных люцифераз и их мутантных форм предоставляет разнообразные возможности для практического применения этих ферментов в науке. Несмотря на большое количество уже существующих приложений, все упомянутые белки имеют потенциал для использования в новых методах или улучшения существующих. Каждая из применяемых люцифераз имеет свой набор недостатков. Однако недостаток для одного метода может быть преимуществом для другого. Нет универсального совета по выбору люциферазы для разработки новых аналитических методов, однако следует, в первую очередь, учитывать несколько основных параметров, таких, как: термостабильность, оптимум рН и максимум люминесценции (рис. 6). Авторы надеются, что данный обзор поможет исследователям подобрать фермент для решения конкретной задачи. За рамками обзора остается несколько десятков менее изученных биолюминесцентных систем, освоение которых, вероятно, значительно расширит существующие возможности применения биолюминесценции в биомедицине.
Рис. 6. Основные практически значимые достоинства и недостатки природных люцифераз
Об авторах
А. А. Котлобай
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Автор, ответственный за переписку.
Email: alexey_kotlobay@ibch.ru
Россия, Москва
З. М. Каськова
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН; НИИ трансляционной медицины, Российский национальный исследовательский университет им. Н.И. Пирогова
Email: alexey_kotlobay@ibch.ru
Россия, Москва
И. В. Ямпольский
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, НИИ трансляционной медицины; Российский национальный исследовательский университет им. Н.И. Пирогова
Email: alexey_kotlobay@ibch.ru
Россия, Москва
Список литературы
- Weissleder R., Pittet M.J. // Nature. 2008. V. 452. № 7187. P. 580–589.
- Kaskova Z.M., Tsarkova A.S., Yampolsky I.V. // Chem. Soc. Rev. 2016. V. 45. № 21. P. 6048–6077.
- Shimomura O., Johnson F.H. // Proc. Natl. Acad. Sci. USA. 1978. V. 75. № 6. P. 2611–2615.
- Eremeeva E.V., Markova S.V., Westphal A.H., Visser A.J.W.G., van Berkel W.J.H., Vysotski E.S. // FEBS Lett. 2009. V. 583. № 12. P. 1939–1944.
- Nakamura H., Kishi Y., Shimomura O., Morse D., Hastings J.W. // J. Am. Chem. Soc. 1989. V. 111. № 19. P. 7607–7611.
- Kotlobay A.A., Dubinnyi M.A., Purtov K.V., Guglya E.B., Rodionova N.S., Petushkov V.N., Bolt Y.V., Kublitski V.S., Kaskova Z.M., Ziganshin R.H., et al. // Proc. Natl. Acad. Sci. USA. 2019. V. 116. № 38. P. 18911–18916.
- Wood K.V. // Photochem. Photobiol. 1995. V. 62. P. 662–673.
- Viviani V.R. // Cell. Mol. Life Sci. 2002. V. 59. № 11. P. 1833–1850.
- Ugarova N.N. // J. Biolumin. Chemilumin. 1989. V. 4. № 1. P. 406–418.
- Conti E., Franks N.P., Brick P. // Structure. 1996. V. 4. № 3. P. 287–298.
- Sundlov J.A., Fontaine D.M., Southworth T.L., Branchini B.R., Gulick A.M. // Biochemistry. 2012. V. 51. № 33. P. 6493–6495.
- Nakatsu T., Ichiyama S., Hiratake J., Saldanha A., Kobashi N., Sakata K., Kato H. // Nature. 2006. V. 440. № 7082. P. 372–376.
- Waud J.P., Sala-Newby G.B., Matthews S.B., Campbell A.K. // Biochim. Biophys. Acta. 1996. V. 1292. № 1. P. 89–98.
- Branchini B.R., Magyar R.A., Murtiashaw M.H., Anderson S.M., Zimmer M. // Biochemistry. 1998. V. 37. № 44. P. 15311–15319.
- Seliger H.H., McElroy W.D. // Arch. Biochem. Biophys. 1960. V. 88. № 1. P. 136–141.
- Ando Y., Niwa K., Yamada N., Enomoto T., Irie T., Kubota H., Ohmiya Y., Akiyama H. // Nat. Photonics. 2008. V. 2. № 1. P. 44–47.
- Seliger H.H., McElroy W.D. // Proc. Natl. Acad. Sci. USA. 1964. V. 52. № 1. P. 75–81.
- Wang Y., Kubota H., Yamada N., Irie T., Akiyama H. // Photochem. Photobiol. 2011. V. 87. № 4. P. 846–852.
- Viviani V.R., Bechara E.J.H. // Photochem. Photobiol. 1995. V. 62. P. 490–495.
- Viviani V.R., Gabriel G.V.M., Bevilaqua V.R., Simões A.F., Hirano T., Lopes-de-Oliveira P.S. // Sci. Rep. 2018. V. 8. № 1. P. 1–14.
- Moradi A., Hosseinkhani S., Naderi-Manesh H., Sadeghizadeh M., Alipour B.S. // Biochemistry. 2009. V. 48. № 3. P. 575–582.
- Viviani V.R., Amaral D.T., Neves D.R., Simões A., Arnoldi F.G.C. // Biochemistry. 2013. V. 52. № 1. P. 19–27.
- Hall M.P., Woodroofe C.C., Wood M.G., Que I., Van’T Root M., Ridwan Y., Shi C., Kirkland T.A., Encell L.P., Wood K. V., et al. // Nat. Commun. 2018. V. 9. № 1. P. 132.
- Ikeda Y., Nomoto T., Hiruta Y., Nishiyama N., Citterio D. // Anal. Chem. 2020. V. 92. № 6. P. 4235–4243.
- Iwano S., Sugiyama M., Hama H., Watakabe A., Hasegawa N., Kuchimaru T., Tanaka K.Z., Takahashi M., Ishida Y., Hata J., et al. // Science. 2018. V. 359. № 6378. P. 935–939.
- Welsh D.K., Noguchi T. // Cold Spring Harb. Protoc. 2012. V. 7. № 8. P. 852–866.
- Pelentir G.F., Bevilaqua V.R., Viviani V.R. // Photochem. Photobiol. Sci. 2019. V. 18. P. 2061–2070.
- Smirnova D.V., Ugarova N.N. // Photochem. Photobiol. 2017. V. 93. № 2. P. 436–447.
- Koksharov M.I., Ugarova N.N. // Comput. Struct. Biotechnol. J. 2012. V. 2. № 3. P. e201209004.
- Colepicolo-Neto P., Costa C., Bechara E.J.H. // Insect Biochem. 1986. V. 16. № 5. P. 803–810.
- Amaral D.T., Oliveira G., Silva J.R., Viviani V.R. // Photochem. Photobiol. Sci. 2016. V. 15. № 9. P. 1148–1154.
- Wood K.V., Lam Y.A., Seliger H.H., McElroy W.D. // Science. 1989. V. 244. № 4905. P. 700–702.
- Viviani V.R., Silva A.C., Perez G.L., Santelli R.V., Bechara E.J., Reinach F.C. // Photochem. Photobiol. 1999. V. 70. № 2. P. 254–260.
- Nakajima Y., Yamazaki T., Nishii S., Noguchi T., Hoshino H., Niwa K., Viviani V.R., Ohmiya Y. // PLoS One. 2010. V. 5. № 4. P. e10011.
- Viviani V.R., Uchida A., Viviani W., Ohmiya Y. // Photochem. Photobiol. 2002. V. 76. № 5. P. 538–544.
- Viviani V.R., Bechara E.J.H. // Ann. Entomol. Soc. Am. 1997. V. 90. P. 389–398.
- Viviani V.R., Bechara E.J., Ohmiya Y. // Biochemistry. 1999. V. 38. № 26. P. 8271–8279.
- Viviani V.R., Bechara E.J.H. // Photochem. Photobiol. 1993. V. 58. P. 615–622.
- Gruber M.G., Kutuzova G.D., Wood K. V. Bioluminescence and chemiluminescence: Molecular reporting with photons: Proc. 9th International Symp. Chichester: Wiley, 1997. P. 244–247.
- Shimomura O. Bioluminescence: Chemical principles and methods. Singapore: World Scientific, 2019. P. 177–198.
- Titushin M.S., Markova S.V., Frank L.A., Malikova N.P., Stepanyuk G.A., Lee J., Vysotski E.S. // Photochem. Photobiol. Sci. 2008. V. 7. № 2. P. 189–196.
- Charbonneau H., Cormier M.J. // J. Biol. Chem. 1979. V. 254. № 3. P. 769–780.
- Ward W.W., Cormier M.J. // J. Biol. Chem. 1979. V. 254. № 3. P. 781–788.
- Loening A.M., Fenn T.D., Wu A.M., Gambhir S.S. // Protein Eng. Des. Sel. 2006. V. 19. № 9. P. 391–400.
- Loening A.M., Fenn T.D., Gambhir S.S. // J. Mol. Biol. 2007. V. 374. № 4. P. 1017–1028.
- Matthews J.C., Hori K., Cormier M.J. // Biochemistry. 1977. V. 16. № 1. P. 85–91.
- Rahnama S., Saffar B., Kahrani Z.F., Nazari M., Emamzadeh R. // Enzyme Microb. Technol. 2017. V. 96. P. 60–66.
- Woo J., von Arnim A.G. // Plant Methods. 2008. V. 4. P. 23.
- Loening A.M., Wu A.M., Gambhir S.S. // Nat. Methods. 2007. V. 4. № 8. P. 641–643.
- Abe M., Nishihara R., Ikeda Y., Nakajima T., Sato M., Iwasawa N., Nishiyama S., Paulmurugan R., Citterio D., Kim S.B., et al. // ChemBioChem. 2019. V. 20. № 15. P. 1919–1923.
- Markova S.V., Vysotski E.S. // Biochemistry. 2015. V. 80. № 6. P. 714–732.
- Borisova V.V., Frank L.A., Markova S.V., Burakova L.P., Vysotski E.S. // Photochem. Photobiol. Sci. 2008. V. 7. № 9. P. 1025–1031.
- Verhaegent M., Christopoulos T.K. // Anal. Chem. 2002. V. 74. № 17. P. 4378–4385.
- Tannous B.A., Kim D.-E., Fernandez J.L., Weissleder R., Breakefield X.O. // Mol. Ther. 2005. V. 11. № 3. P. 435–443.
- Markova S.V., Golz S., Frank L.A., Kalthof B., Vysotski E.S. // J. Biol. Chem. 2004. V. 279. № 5. P. 3212–3217.
- Bryan B.J., Szent-Gyorgyi C. U.S. Patent 6232107, WO1999049019A8, 2001.
- Markova S.V., Burakova L.P., Vysotski E.S. // Biochem. Biophys. Res. Commun. 2012. V. 417. № 1. P. 98–103.
- Inouye S., Sahara Y. // Biochem. Biophys. Res. Commun. 2008. V. 365. № 1. P. 96–101.
- Remy I., Michnick S.W. // Nat. Methods. 2006. V. 3. № 12. P. 977–979.
- Stepanyuk G.A., Xu H., Wu C.K., Markova S.V., Lee J., Vysotski E.S., Wang B.C. // Protein Expr. Purif. 2008. V. 61. № 2. P. 142–148.
- Markova S.V., Larionova M.D., Burakova L.P., Vysotski E.S. // Biochem. Biophys. Res. Commun. 2015. V. 457. № 1. P. 77–82.
- Larionova M.D., Markova S.V., Vysotski E.S. // J. Photochem. Photobiol. B Biol. 2018. V. 183. P. 309–317.
- Markova S.V., Larionova M.D., Gorbunova D.A., Vysotski E.S. // J. Photochem. Photobiol. B Biol. 2017. V. 175. P. 51–57.
- Takenaka Y., Masuda H., Yamaguchi A., Nishikawa S., Shigeri Y., Yoshida Y., Mizuno H. // Gene. 2008. V. 425. № 1–2. P. 28–35.
- Degeling M.H., Bovenberg M.S.S., Lewandrowski G.K., De Gooijer M.C., Vleggeert-Lankamp C.L.A., Tannous M., Maguire C.A., Tannous B.A. // Anal. Chem. 2013. V. 85. № 5. P. 3006–3012.
- Chung E., Yamashita H., Au P., Tannous B.A., Fukumura D., Jain R.K. // PLoS One. 2009. V. 4. № 12. P. e8316.
- Lupold S.E., Johnson T., Chowdhury W.H., Rodriguez R. // PLoS One. 2012. V. 7. № 5. P. e36535.
- Tannous B.A., Teng J. // Biotechnol. Adv. 2011. V. 29. № 6. P. 997–1003.
- Markova S.V., Larionova M.D., Vysotski E.S. // Photochem. Photobiol. 2019. V. 95. № 3. P. 705–721.
- Kim S.B., Suzuki H., Sato M., Tao H. // Anal. Chem. 2011. V. 83. № 22. P. 8732–8740.
- Larionova M.D., Markova S.V., Vysotski E.S. // Biochem. Biophys. Res. Commun. 2017. V. 483. № 1. P. 772–778.
- Shimomura O., Masugi T., Johnson F.H., Haneda Y. // Biochemistry. 1978. V. 17. № 6. P. 994–998.
- Inouye S., Watanabe K., Nakamura H., Shimomura O. // FEBS Lett. 2000. V. 481. № 1. P. 19–25.
- Inouye S., Sasaki S. // Protein Expr. Purif. 2007. V. 56. № 2. P. 261–268.
- Hall M.P., Unch J., Binkowski B.F., Valley M.P., Butler B.L., Wood M.G., Otto P., Zimmerman K., Vidugiris G., Machleidt T., et al. // ACS Chem. Biol. 2012. V. 7. № 11. P. 1848–1857.
- Inouye S., Sato J.-I., Sahara-Miura Y., Yoshida S., Hosoya T. // Biochem. Biophys. Res. Commun. 2014. V. 445. № 1. P. 157–162.
- Kishi T., Goto T., Hirata Y., Shimomura O., Johnson F.H. // Tetrahedron Lett. 1966. V. 7. № 29. P. 3427–3436.
- Shimomura O., Johnson F.H. // Biochem. Biophys. Res. Commun. 1971. V. 44. № 2. P. 340–346.
- Oba Y., Tsuduki H., Kato S.I., Ojika M., Inouye S. // ChemBioChem. 2004. V. 5. № 11. P. 1495–1499.
- Thompson E.M., Nagata S., Tsuji F.I. // Proc. Natl. Acad. Sci. USA. 1989. V. 86. № 17. P. 6567–6571.
- Nakajima Y., Kobayashi K., Yamagishi K., Enomoto T., Ohmiya Y. // Biosci. Biotechnol. Biochem. 2004. V. 68. № 3. P. 565–570.
- Shimomura O., Johnson F.H. // Photochem. Photobiol. 1970. V. 12. № 4. P. 291–295.
- Mitani Y., Oshima Y., Mitsuda N., Tomioka A., Sukegawa M., Fujita M., Kaji H., Ohmiya Y. // Protein Expr. Purif. 2017. V. 133. P. 102–109.
- Yasuno R., Mitani Y., Ohmiya Y. // Photochem. Photobiol. 2018. V. 94. № 2. P. 338–342.
- Shimomura O. Bioluminescence: chemical principles and methods. Singapore: World Scientific, 2019. P. 33–49.
- Ulitzur S., Hastings J.W. // Proc. Natl. Acad. Sci. USA. 1979. V. 76. № 1. P. 265–267.
- Cline T.W., Hastings J.W. // Biochemistry. 1972. V. 11. № 18. P. 3359–3370.
- Cohn D.H., Mileham A.J., Simon M.I., Nealson K.H., Rausch S.K., Bonam D., Baldwin T.O. // J. Biol. Chem. 1985. V. 260. № 10. P. 6139–6146.
- Johnston T.C., Thompson R.B., Baldwin T.O. // J. Biol. Chem. 1986. V. 261. № 11. P. 4805–4811.
- Sinclair J.F., Waddle J.J., Waddill E.F., Baldwin T.O. // Biochemistry. 1993. V. 32. № 19. P. 5036–5044.
- Baldwin T.O., Ziegler M.M., Chaffotte A.F., Goldberg M.E. // J. Biol. Chem. 1993. V. 268. № 15. P. 10766–10772.
- Swanson R., Weaver L.H., Remington S.J., Matthews B.W., Baldwin T.O. // J. Biol. Chem. 1985. V. 260. № 2. P. 1287–1289.
- Fisher A.J., Rayment I., Raushel F.M., Baldwin T.O. // Biochemistry. 1995. V. 34. № 20. P. 6581–6586.
- AbouKhair N.K., Ziegler M.M., Baldwin T.O. // Biochemistry. 1985. V. 24. № 15. P. 3942–3947.
- Baldwin T.O., Chen L.H., Chulimsky L.J., Devine J.H., Johnston T.C., Lin J.W., Sugihara J., Waddle J.J., Zegler M.M. Flavins and Flavoproteins. Berlin: Walter de Gruyter, 1987. P. 621–631.
- Xin X., Xi L., Tu S.C. // Biochemistry. 1991. V. 30. № 47. P. 11255–11262.
- Wilmanns M., Hyde C.C., Davies D.R., Kirschner K., Jansonius J.N. // Biochemistry. 1991. V. 30. № 38. P. 9161–9169.
- Nakamura T., Matsuda K. // J. Biochem. 1971. V. 70. № 1. P. 35–44.
- Hastings J.W., Baldwin T.O., Nicoli M.Z. // Methods Enzymol. 1978. V. 57. P. 135–152.
- Friedland J., Hastings J.W. // Biochemistry. 1967. V. 6. № 9. P. 2893–2900.
- Szittner R., Meighen E. // J. Biol. Chem. 1990. V. 265. № 27. P. 16581–16587.
- Hamorsky K.T., Dikici E., Ensor C.M., Daunert S., Davis A.L., Branchini B.R. Chemiluminescence and bioluminescence: Past, present and future. Cambridge: Royal Society of Chemistry, 2010. P. 443–487.
- Rocchetta H.L., Boylan C.J., Foley J.W., Iversen P.W., Letourneau D.L., McMillian C.L., Contag P.R., Jenkins D.E., Parr J. // Antimicrob. Agents Chemother. 2001. V. 45. № 1. P. 129–137.
- Riedel C.U., Monk I.R., Casey P.G., Morrissey D., O’Sullivan G.C., Tangney M., Hill C., Gahan C.G.M. // Appl. Environ. Microbiol. 2007. V. 73. № 9. P. 3091–3094.
- Hardy J., Francis K.P., DeBoer M., Chu P., Gibbs K., Contag C.H. // Science. 2004. V. 303. № 5659. P. 851–853.
- Francis K.P., Joh D., Bellinger-Kawahara C., Hawkinson M.J., Purchio T.F., Contag P.R. // Infect. Immun. 2000. V. 68. № 6. P. 3594–3600.
- Francis K.P., Yu J., Bellinger-Kawahara C., Joh D., Hawkinson M.J., Xiao G., Purchio T.F., Caparon M.G., Lipsitch M., Contag P.R. // Infect. Immun. 2001. V. 69. № 5. P. 3350–3358.
- Phillips-Jones M.K. // FEMS Microbiol. Lett. 1993. V. 106. № 3. P. 265–270.
- Cronin M., Sleator R.D., Hill C., Fitzgerald G.F., van Sinderen D. // BMC Microbiol. 2008. V. 8. № 1. P. 161.
- Gupta R.K., Patterson S.S., Ripp S., Simpson M.L., Sayler G.S. // FEMS Yeast Res. 2003. V. 4. № 3. P. 305–313.
- Patterson S.S., Dionisi H.M., Gupta R.K., Sayler G.S. // J. Ind. Microbiol. Biotechnol. 2005. V. 32. № 3. P. 115–123.
- Gregor C., Pape J.K., Gwosch K.C., Gilat T., Sahl S.J., Hell S.W. // Proc. Natl. Acad. Sci. USA. 2019. V. 116. № 52. P. 26491–26496.
- Purtov K.V., Petushkov V.N., Baranov M.S., Mineev K.S., Rodionova N.S., Kaskova Z.M., Tsarkova A.S., Petunin A.I., Bondar V.S., Rodicheva E.K., et al. // Angew. Chem. Int. Ed. Engl. 2015. V. 54. № 28. P. 8124–8128.
- Kotlobay A.A., Sarkisyan K.S., Mokrushina Y.A., Marcet-Houben M., Serebrovskaya E.O., Markina N.M., Gonzalez Somermeyer L., Gorokhovatsky A.Y., Vvedensky A., Purtov K.V., et al. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 50. P. 12728–12732.
- Mitiouchkina T., Mishin A.S., Somermeyer L.G., Markina N.M., Chepurnyh T.V., Guglya E.B., Karataeva T.A., Palkina K.A., Shakhova E.S., Fakhranurova L.I., et al. // Nat. Biotechnol. 2020. In press. doi: 10.1038/s41587-020-0500-9
- Kaskova Z.M., Dörr F.A., Petushkov V.N., Purtov K.V., Tsarkova A.S., Rodionova N.S., Mineev K.S., Guglya E.B., Kotlobay A., Baleeva N.S., et al. // Sci. Adv. 2017. V. 3. № 4. P. e1602847.
Дополнительные файлы