Направленный транспорт лекарственных препаратов в липидоподобных наноконтейнерах и внеклеточных везикулах
- Авторы: Соколов А.В.1, Костин Н.Н.1, Овчинникова Л.А.1, Ломакин Я.А.1, Кудряева А.А.1
-
Учреждения:
- Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
- Выпуск: Том 11, № 2 (2019)
- Страницы: 28-41
- Раздел: Обзоры
- Дата подачи: 21.01.2020
- Дата публикации: 15.06.2019
- URL: https://actanaturae.ru/2075-8251/article/view/10838
- DOI: https://doi.org/10.32607/20758251-2019-11-2-28-41
- ID: 10838
Цитировать
Аннотация
Возможность адресной доставки препаратов к определенным органам-мишеням, тканям и клеткам открыла невероятные перспективы для разработки новых способов терапии. Технология направленного транспорта нацелена на создание многофункциональных носителей, способных к длительной циркуляции в организме пациента и обладающих низкой токсичностью. Поверхность современных синтетических носителей обладает высоким структурным сходством с клеточной мембраной, что в сочетании с дополнительными модификациями способствует передаче и биологических свойств, позволяя эффективно преодолевать физиологические барьеры. Наряду с искусственными контейнерами все большее внимание уделяется исследованию внеклеточных везикул в качестве естественных переносчиков лекарственных средств. В обзоре рассмотрены системы направленного транспорта с помощью липидных и липидоподобных наночастиц, а также внеклеточных везикул, обладающих высоким уровнем биосовместимости. Особое внимание уделено генетически кодируемым переносчикам терапевтических средств.
Ключевые слова
Полный текст
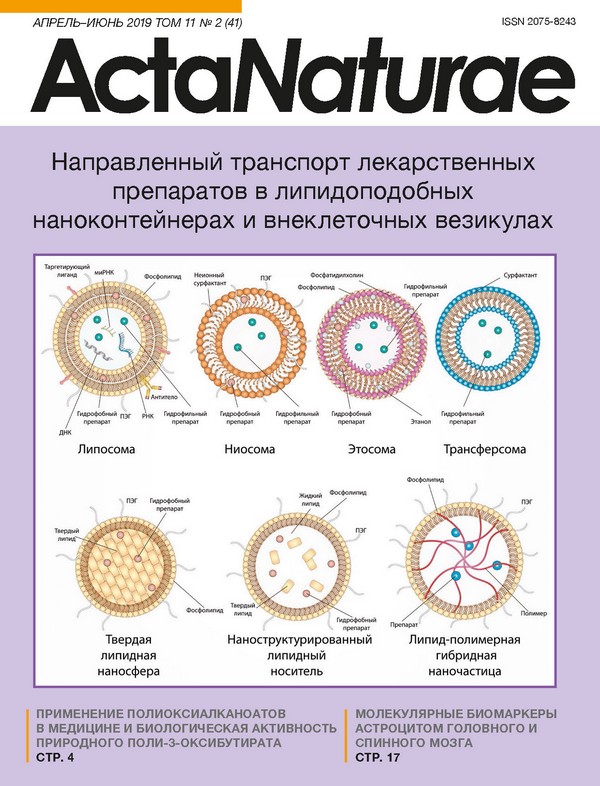
ВВЕДЕНИЕ При создании современных терапевтических препа ратов наряду с низкомолекулярными соединениями все чаще используют биополимеры и их фрагменты: белки, пептиды, олигонуклеотиды, РНК или ДНК. Для исключения потери активности из-за внешних факторов способы приготовления лекарственных средств и их введения в организм пациента должны удовлетворять определенным требованиям. Однако основной проблемой на пути внедрения потенциаль ных терапевтических соединений в клиническую практику представляет сложность доставки препа рата в целевые клетки. Доставку без использования носителей в значительной степени затрудняют пре ждевременная деградация препарата в организме и низкая проницаемость клеточных мембран, поэто му разработка и оптимизация методов доставки ле карственных веществ относятся к одним из наиболее изучаемых направлений нанобиомедицины. Существующие системы доставки можно разде лить на две группы: вирусные (лентивирусы, аде новирусы, ретровирусы) [1] и невирусные (макро и наночастицы, полимерные частицы) [2]. Быстрое развитие нанотехнологий способствует созданию новых методов доставки на основе наночастиц из различных материалов, обладающих разнообраз ными поверхностными характеристиками и физи ко-химическими свойствами, удовлетворяющими условиям конкретной задачи [3]. Однако каждый тип наночастиц обладает как преимуществами, так и определенными недостатками, ограничиваю щими их применение. Разрабатываемые нанокон тейнеры способны выступать в качестве носителей как белковых препаратов [4], так и ДНК [5], и РНК [6]. Наночастицы, полученные из природных по лимеров, таких, как фосфолипиды, полисахариды, белки и пептиды, более эффективны, чем наноча стицы из синтетических полимеров, благодаря их биосовместимости [7] и отсутствию токсичных про дуктов деградации [8]. Используемые в настоящее время наноразмерные фармацевтические контей неры-носители обладают множеством полезных свойств, включая эффективную внутриклеточную доставку и длительную циркуляцию в кровотоке, сниженную токсичность благодаря преимуществен ному накоплению в целевой области, улучшенную фармакокинетику и биораспределение терапевти ческого агента, а также способность к высвобожде нию содержимого контейнера под действием опре деленных физиологических условий [9]. Кроме того, активно изучается возможность использования внеклеточных везикул в качестве природной систе мы доставки лекарственных препаратов. При этом исследуют как интактные везикулы, так и везику лы, предварительно нагруженные терапевтическим агентом [10]. В данном обзоре мы подробнее рассмо трим особенности липидных и липидоподобных си стем доставки, уделив особое внимание перспекти вам использования внеклеточных везикул. ЛИПИДНЫЕ И ЛИПИДОПОДОБНЫЕ СИСТЕМЫ ДОСТАВКИ Первым, универсальным, наиболее изученным и широко применяемым носителем лекарств явля ется липосома и ее производные. За последние 10 лет разработано множество систем с использованием наноносителей на основе липидных и липидоподоб ных везикул, включая липосомы (liposomes), ниосо мы (niosomes), этосомы (ethosomes), трансферсомы (transfersomes), твердые липидные наночастицы (SLN, solid lipid nanoparticles), наноструктурирован ные липидные носители (NLС, nanostructured lipid carriers), а также гибридные липид-полимерные на ночастицы (LPN, lipid-polymer hybrid nanoparticles). Схематическая структура перечисленных наноно сителей показана на рис. 1. Липидные наноносите ли чаще всего состоят из физиологических липидов, что обеспечивает безопасную и эффективную до ставку, а также повышенную биодоступность тера певтических агентов. Эти наночастицы нетоксичны и расщепляются в организме наряду с эндогенными липидами. Липосомы Липосомы, являющиеся самым распространенным способом доставки, впервые были описаны в 1965 году [11]. Функциональный каркас липосомы, со стоящий из двухслойной липидной оболочки, обу славливает не только высокую подвижность формы, но и способность везикул имитировать биофизиче ские свойства живых клеток. Липосомы состоят в основном из природных и/или синтетических фосфо- и сфинголипидов, чаще всего фосфатидилхолина и фосфатидилэта ноламина - основных структурных элементов био логических мембран. Но и другие фосфолипиды, такие, как фосфатидилсерин, фосфатидилглицерин и фосфатидилинозит могут дополнительно использо ваться при получении липосом [12]. Размер липосом варьирует практически в пределах трех порядков: различают двухслойные (моноламеллярные), кото рые в свою очередь делятся на малые SUV (25-50 нм) и большие LUV (≥ 100 нм), а также многослой ные (мультиламеллярные) липосомы MLV разме ром 0.05-10 мкм. Самый простой способ получения SUV - обработка дисперсии липидов ультразвуком. MLV получают путем смешивания предварительно полученных SUV c водным раствором терапевти ческого агента с последующей лиофилизацией [13] или гидратацией липидных пленок, при этом до бавление органических растворителей в процессе гидратации увеличивает эффективность инкапсу ляции с 10 до 40% [14]. LUV получают с помощью об ратного фазового испарения [15] или методом удале ния детергента [16]. Помимо классификации липосом по размеру, существует разделение и по заряду в зависимости от входящих в состав липидов и фос фолипидов: нейтральные (фосфатидилхолин и фос фатидилэтаноламин), анионные (фосфатидилсерин, фосфатидилглицерин, фосфатидные кислоты и фос фатидилинозит), катионные (стеариламин или DC холестерин) [17-19]. Традиционные «липосомы первого поколения» на основе фосфолипидов обладают низкой стабиль ностью и быстро деградируют после введения в ор ганизм, что является существенным недостатком, особенно при доставке цитотоксических препара тов [20]. Для стабилизации липосом может исполь зоваться хитозан - природный гидрофильный био разлагаемый полимер с низкой токсичностью [21]. Но даже стабильные липосомы, независимо от их заряда и размера, весьма эффективно поглощаются клетками ретикулоэндотелиальной системы (РЭС), находящимися в печени и селезенке, что активно ис пользуется при заболеваниях, связанных с пораже нием данных органов. Однако для увеличения време ни циркуляции и эффективности доставки в другие ткани и органы липосомы делают «невидимыми» для РЭС (stealth liposome) путем модификации их поверхности биосовместимым инертным гидрофиль ным полимером - полиэтиленгликолем (ПЭГ) [22, 23], дополнительно блокируя взаимодействия с белка ми крови [24, 25]. Также разработаны «суперневи димые» липосомы (SSL, super stealth liposomes), где ПЭГ закреплен посредством β-глутаминовой кисло ты на нескольких молекулах фосфоэтаноламина [26]. Данная композиция, как и увеличение длины цепи ПЭГ, повышает стабильность липосом, продлевает период полувыведения, улучшает профиль биора спределения [26, 27]. Совсем недавно было показано, что доставка терапевтических агентов путем транс портировки наночастиц на поверхности эритроцитов может быть чрезвычайно эффективной даже при ма лом времени циркуляции в кровотоке [28]. Помимо увеличения стабильности и времени циркуляции препарата в кровотоке, в большинстве случаев требуется направленная доставка к опреде ленным клеткам-мишеням. Для решения подобных задач разработано множество дополнительных мо дификаций липосом, например, включение диолео илфосфатидилэтаноламина (DOPE) в состав кати онных липосом способствует эффективной доставке в предшественники дендритных клеток (ДК) [29], а маннозилирование липосом увеличивает их захват непосредственно ДК [30]. Модификация липосом искусственным полипептидом DARPin, специфич ным к опухолевому рецептору HER2, способствует эффективной доставке наночастиц в клетки, экс прессирующие данный рецептор [31]. В настоящее время на стадии клинических испытаний находятся несколько препаратов на основе таргетированных липосом. Среди них наиболее перспективными ка жутся препараты MCC-465 (модифицированные ПЭГ липосомы, несущие доксорубицин и димеры F(ab’) фрагментов) [32], MM-302 (модифицированные ПЭГ липосомы, специфичные к HER2, несущие доксору бицин) [33], 2B3-101 (липосомы, несущие на поверх ности глутатион), MBP-426 и SGT-53 (липосомы, не сущие в качестве вектора трансферрин и TfRscFv (anti-transferrin receptor single-chain antibody) соот ветственно) [34, 35]. Помимо антител, их фрагментов и пептидов, для модификации поверхности липосом с целью повышения их селективности могут также использоваться нуклеиновые кислоты и неболь шие молекулы [36]. Среди перечисленных лигандов для адресной доставки особое место занимают апта меры, которые считаются одними из самых перспек тивных кандидатов с уникальными характеристи ками [37]. Таким образом, липосомы на настоящий момент являются одним из самых универсальных способов доставки: с их помощью возможна достав ка широкого спектра лекарственных средств, в том числе противоопухолевых и противомикробных пре паратов, ферментов, вакцин, ДНК и РНК. В настоящее время в клинической практике при меняется множество терапевтических агентов, ин капсулированных в липосомы, еще большее их чис ло находится на стадии клинических испытаний [38]. Впервые липосомный носитель был введен в клини ческую практику в 1995 году. Им стал противоопу холевый препарат Doxil™/Caelyx™ [39]. Кроме того, в терапии злокачественной трансформации исполь зуют препараты Myocet™, DaunoXome™, Depocyt™, Marqibo™, Onivyde™, AmBisome™, DepoDur™, Visudyne™, Abelcet™ и Curosurf™. Липосомы также проходят испытания в качестве носителей средств против аутоиммунных заболева ний, в частности ревматоидного артрита и рассеян ного склероза (РС). Например, препарат Xemys - это инкапсулированная в маннозилированные SUV смесь иммунодоминантных пептидов основного бел ка миелина (MBP, myelin basic protein), одного из ос новных аутоантигенов при рассеянном склерозе. Полноразмерный основный белок миелина, а также его фрагменты долгое время рассматривали в ка честве средства, эффективного при аутоиммунной нейродегенерации [40]. Показано, что введение опре деленных пептидов MBP, инкапсулированных в ли посомы, подавляет развитие экспериментального ау тоиммунного энцефаломиелита (ЭАЭ) у модельных животных [41]. На настоящий день успешно проведе ны I и II стадии клинических испытаний препарата Xemys, одобрено проведение III стадии [42]. Благодаря модификации поверхности липосом остатками ман нозы, инкапсулированные в липосомы пептиды MBP захватываются в основном профессиональными АПК (антигенпредставляющими клетками) - ма крофагами и ДК через маннозные рецепторы CD206. Предполагается, что избыточная презентация фраг ментов MBP в составе молекул MHC класса II на по верхности АПК способствует индукции толерантно сти к данному белку и, как следствие, уменьшению аутоиммунного воспаления. В сыворотке больных РС, получавших препарат Xemys, выявлено снижение уровней моноцитарного хемотаксического фактора-1 (MCP-1/CCL2), макрофагов, воспалительного бел ка-1 (MIP-1/CCL4), интерлейкинов ИЛ-2 и ИЛ-7 [43]. Кроме того, исследовано влияние пептидов MBP46- 62, 124-139 и 147-170, входящих в состав препарата, на высвобождение цитокинов и активацию иммунных клеток у больных РС и здоровых доноров [44]. Способность липосом направленно доставлять тре буемый антиген к АПК и тем самым модулировать иммунный ответ широко используется при разработ ке противовирусных и бактериальных вакцин. В на стоящее время ряд липосомных препаратов нахо дится на стадии клинических испытаний в качестве адъювантов профилактических и терапевтических вакцин против малярии, гриппа, туберкулеза, ви руса иммунодефицита человека (ВИЧ) и лихорадки денге [45], тогда как препараты Cervarix™, Inflexal™ и Epaxal™ уже являются коммерчески доступными липосомными вакцинами против вируса папилломы человека (ВПЧ), вируса гриппа и вируса гепатита A соответственно [46]. Ниосомы Ниосомы представляют собой везикулы (50-800 нм), состоящие из двойного слоя неионного сурфактан та, часто дополнительно содержащие холестерин или его производные [47]. Структура ниосом по зволяет инкапсулировать в них как гидрофильные, так и липофильные соединения, при этом гидро фильный агент располагается во внутреннем водном пространстве, в то время как липофильный - внутри бислоя. Свойства данных везикул могут варьировать в зависимости от размера, ламеллярности и заряда поверхности. В качестве системы доставки ниосомы обладают некоторыми преимуществами перед клас сическими липосомами: имеют большее время полу жизни, просты в получении и легко подвергаются модификациям, обладают высокой совместимостью с биологическими системами и низкой токсичностью благодаря своей неионной природе, неиммуногенны и подвергаются биодеградации [48]. Кроме того, нио сомы практически не распознаются ретикулоэндоте лиальной системой. К недостаткам ниосом относится невысокая стабильность (хотя и более высокая, чем у липосом), склонность к агрегации и частичный вы ход инкапсулированного агента из наноконтейнера в процессе доставки [49]. Несмотря на большое количество публикаций, по священных изучению возможных составов и приме нению ниосом, лишь немногие препараты доведены до клинических испытаний [47]. Большинство испы таний показало, что инкапсуляция лекарственных препаратов в ниосомы имеет ряд преимуществ, та ких, как большая эффективность, уменьшение коли чества побочных эффектов, удобный способ введе ния. Так, ниосомы эффективны при внутривенном, внутримышечном, пероральном, внутриглазном, подкожном, легочном, внутрибрюшинном и транс дермальном введении [50]. Данный вид везикул ис пользуется для инкапсуляции таких препаратов, как доксорубицин, инсулин, овальбумин, олигону клеотиды, EGFP, гемагглютинин, ДНК-вакцины, α-интерферон и многие другие [51]. Кроме того, ни осомы используют для введения в глаз препарата такролимус после трансплантации роговицы [52], пероральной доставки метформина [53], а также в косметической промышленности. Этосомы Этосомы, впервые описанные в 1996 году, пред ставляют собой модификацию классических липо сом и состоят из фосфолипидов, этанола (20-45%) и воды [54]. Помимо этанола, этосомы могут содер жать пропиленгликоль или изопропиловый спирт. В зависимости от способа приготовления этосомы имеют размер от нескольких десятков нанометров до нескольких микрон. В этосомы могут быть инкап сулированы как гидрофильные, так и липофильные лекарственные средства; увеличение концентрации этанола в этосомах способствует повышению раство римости соединений и тем самым включению боль шего количества терапевтического агента. Известно, что этосомы значительно превосходят классические липосомы для доставки трансдермальных форм ле карственных средств из-за наличия отрицательного ζ-потенциала. Кроме того, этанол приводит к дезор ганизации липидов рогового слоя кожи, что значи тельно повышает эффективность проникновения ча стиц лекарственных средств в глубокие слои дермы. Накопление препарата в дермальных слоях приводит к эффекту замедленного высвобождения вещества из этосом, что способствует пролонгации лечебного действия [55]. К недостаткам этосом относят довольно частые аллергические реакции на спирт или другие их компоненты [56], а также возможность примене ния исключительно для трансдермальной доставки. Кроме того, легкая воспламеняемость этанола тре бует повышенных мер предосторожности при приго товлении, применении, транспортировке и хранении данных наноконтейнеров [57]. Трансферсомы Трансферсомы - везикулы, состоящие из фосфа тидилхолина, сурфактанта и этанола, обладают по вышенной проникающей способностью через меж клеточные поры, что достигается путем добавления мембранных модификаторов - холата натрия, стеа риламина, Span 60, Span 80, Tween 60 и Tween 80 - поверхностно-активных веществ, способствующих дестабилизации липидных бислоев и увеличению де формируемости липосомных мембран [58]. В зависи мости от состава трансферсомы, проникающие в слои кожи, либо сохраняют свою интактную структуру, либо происходит их слияние с клеточной мембраной [59]. Благодаря способности легко менять форму, они проходят через поры, диаметр которых в 5-10 раз меньше их собственного диаметра, что обеспечивает высокий уровень проникновения лекарственных ве ществ [60]. Эффективность трансферсом в качестве системы доставки показано на ибупрофене [61], тер бинафине [62] и эмодине [63]. Кроме перечисленных универсальных липидопо добных систем доставки, существует множество моди фикаций, разработанных для многих конкретных слу чаев. Известны термочувствительные [64], магнитные [65], мультифункциональные SMART-липосомы [66], а также фармакосомы - амфифильные фосфолипид ные комплексы лекарственных соединений [67]. Твердые липидные наночастицы В начале 1990-х годов был разработан новый класс липидных частиц - липосферы, или твердые липид ные наносферы SLN (solid lipid nanospheres) [68, 69]. В везикулах данного типа твердый липид - чаще всего нейтральный триглицерид, используют как ма трицу для инкапсуляции лекарственного средства. Возможно также использование насыщенных жирных кислот, тогда как полярные фосфолипиды служат ли пофильными эмульгаторами. Моно- и диглицериды применяют значительно реже из-за их полярности. SLN могут быть получены различными способами: гомогенизацией при высоком давлении, микроэмуль сионным методом и преципитацией липидных частиц при выпаривании растворителя [70]. SLN отличаются от липосом повышенной стабильностью, возможностью контролируемого высвобождения, сравнительно легкими и дешевыми методами приготовления [71], а от везикул из полимерных материалов их отли чает отсутствие токсичности [72]. Хотя SLN имеют много преимуществ по сравнению с существующи ми системами доставки, они обладают и некоторыми недостатками, например, низкой эффективностью инкапсулирования гидрофильных препаратов [18]. Вероятной причиной этого является низкая раствори мость гидрофильных соединений в липидном бислое и матрице. Для улучшения захвата гидрофильных ле карственных средств, например доксорубицина [73] и диминазена [74], применяют два подхода. В первом используют SLN, загруженные маслом, а во втором - модифицируют липидную матрицу путем включения в нее амфифильных соединений, фосфатидилхолина, полиглицерил-3-диизостеарата и сорбита [75]. Кроме того, SLN характеризуются неравномер ным по времени высвобождением лекарственного средства [68, 76]. Данный недостаток пока не удается решить, что накладывает довольно большие ограни чения на применение этих наночастиц, так как вы сокая начальная скорость высвобождения может способствовать серьезным осложнениям, например, при доставке цитотоксичных противоопухолевых препаратов [68]. Наноструктурированные липидные носители Наноструктурированные липидные носители (NLC, nanostructured lipid carriers) - второе поколение ли пидных наночастиц SLN, разработаны в 1999 году с целью устранения проблемы быстрого высвобож дения терапевтического средства, наблюдаемого при использовании SLN [77]. NLC представляют со бой наночастицы, состоящие из твердой липидной матрицы и содержащие дополнительно жидкий ли пид или масло. Смесь твердого и жидкого липида способствует равномерной инкапсуляции соедине ний и предотвращает их быструю диффузию [78, 79]. NLC могут быть получены несколькими способами, из которых наиболее часто используется гомогени зация при высоком давлении, а также микроэмуль сионным методом, фазовой инверсией и др. Первые препараты, содержащие NLC, крем NanoRepair Q10™ и сыворотка NanoRepair Q10™ (Dr. Rimpler GmbH, Германия) были впервые представлены на космети ческом рынке в 2005 году. В настоящее время в про даже представлено более 30 косметических средств, содержащих NLC, однако, фармацевтические пре параты отсутствуют [80, 81]. Липид-полимерные гибридные наночастицы Наконец, сравнительно недавно были разработаны липид-полимерные гибридные наночастицы (LPN, lipid-polymer hybrid nanoparticles), которые сочета ют в себе характеристики как полимерных наноча стиц, так и липосом. В наноконтейнерах этого вида терапевтический препарат инкапсулирован в по лимерное ядро, окруженное липидным бислоем, мо дифицированным ПЭГ [82]. LPN обладают высокой стабильностью и характеризуются равномерным высвобождением загруженного соединения, тогда как липидный бислой обеспечивает высокую био совместимость [83]; сочетание этих факторов сулит им большое будущее в качестве новых эффективных носителей, однако пока их терапевтический эффект не доказан. ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ НА ОСНОВЕ МЕМБРАН ЕСТЕСТВЕННОГО ПРОИСХОЖДЕНИЯ Отдельный интерес представляют средства достав ки на основе мембран природного происхождения, основные достоинства которых - высокая биосов местимость и стабильность получаемого носителя (рис. 2). У этих методов имеется огромный потенциал для создания на их основе интеллектуальных систем доставки [84, 85]. Предполагается возможность ис пользования этих методов для молекулярно-направ ленной терапии, эффективной и легко управляемой. Однако скорее всего вероятными недостатками будут высокая стоимость получения, трудность очистки, а также пониженная стабильность при хранении. Виросомы Виросомы - везикулы, содержащие встроенные в фосфолипидный бислой вирусные гликопротеиды (рис. 2А). В качестве последних выступают такие белки, как нейраминидаза [86], гемагглютинин ви руса гриппа [87] и белок L оболочки вируса гепатита B [88]. Присутствие этих белковых молекул придает везикулам ряд положительных свойств: структур ную стабильность, направленность доставки, а также способствует рецептор-опосредованному эндоцитозу и последующему высвобождению содержимого но сителей в цитоплазму за счет слияния с мембраной лизосомы [89]. Благодаря этим характеристикам ви росомы могут использоваться как носители терапев тических препаратов [87, 90], выступать в роли адъ юванта и в качестве вакцин, некоторые из которых уже допущены к клиническому применению [91, 92]. Ввиду того, что для получения виросом использу ются вирусы, патогенные для человека, опасность и потенциально сильная in vivo иммуногенность яв ляются основными недостатками данного носителя. В настоящее время изучение виросом направлено на возможность их применения в качестве вакцин и адъювантов, используемых в терапии опухолей [93] и при ВИЧ-инфекции [94]. Бактерии C самого рождения ребенок получает от родителей множество видов бактерий, которые населяют его ор ганы, ткани и полости. Подвергнутые генетическим модификациям или трансплантации бактерии могут использоваться для доставки различных соедине ний (рис. 2Б). С этой целью применяют, например, непатогенные бактерии, такие, как Lactococcus lactis, Streptococcus gordonii и др. Активно изучают ре комбинантные молочнокислые бактерии, способные доставлять нужные вещества в слизистые человека и животных [95, 96]. Другие виды бактерий приме няют для разработки подходов к терапии опухолей и диагностике, что во многом обусловлено способно стью таких бактерий, как грамположительные ана эробы рода Сlostridium, проникать, колонизировать и накапливаться в гипоксических и некротических опухолевых тканях. Эти бактерии обладают соб ственной цитотоксичностью, а с помощью генетиче ских модификаций можно придавать им дополни тельные полезные свойства, такие, как регулируемая экспрессия различных терапевтических и визуали зирующих агентов [97, 98]. Бактериальные тени Бактериальные тени (БТ) - носители на основе кле точных оболочек, которые получают путем экспрес сии гена лизиса E бактериофага в грамотрицатель ных бактериях (рис. 2В) [99]. В результате лизиса из клеток удаляется все содержимое цитоплазмы, в том числе и генетический материал, а остаются по верхностные антигенные элементы, такие, как жгу тик, фимбрии и полисахариды. Оболочки на основе БТ обладают собственной адъювантной активностью, что делает их перспективными для разработки вак цин [100]. БТ можно также нагружать низкомоле кулярными агентами, пептидами и ДНК. Для более контролируемой загрузки частиц разработаны различные варианты модификации внутренней поверх ности клеток, в том числе такие, как изменение жи вых клеток перед лизисом [101, 102]. Эукариотические клетки Рассматривается также возможность использования в качестве носителей эукариотических клеток, та ких, как эритроциты, тромбоциты, лимфоциты, ма крофаги, стволовые и дендритные клетки (рис. 2Г) [84, 103]. Среди этих клеток особо выделяют эри троциты, самые распространенные клетки крови, лишенные генетического материала и обладающие большим временем циркуляции в кровотоке. Для за грузки агента можно использовать внутренний объ ем эритроцитов или прикреплять лекарственные средства/частицы/модификаторы к поверхности клетки [104, 105]. Возможно использование клеток иммунной системы и стволовых клеток в качестве носителей благодаря их тропизму к очагам воспале ния и опухолям, а также способности преодолевать гематоэнцефалический барьер (ГЭБ). Кроме того, стволовые клетки могут быть трансдуцированы с це лью продукции интерферонов и интерлейкинов in situ. Показано, что они способны поглощать кремни евые, полимерные и липидные наночастицы без по тери жизнеспособности [84, 106]. Макрофаги могут преодолевать ГЭБ, они активно используются в ка честве носителей наночастиц благодаря способности фагоцитировать частицы и концентрироваться в по раженных тканях, где загруженные препараты по степенно высвобождаются. Этот подход, получивший название «троянского коня», применяется в терапии глиом [107], ВИЧ-пораженных участках мозга и ги поксических солидных опухолей [84]. Генетически кодируемые внеклеточные везикулы Совсем недавно создан новый тип носителей - гене тически кодируемые внеклеточные везикулы (ГКВВ) (рис. 2Д). При помощи расчетных методов разрабо тан самособирающийся трехмерный полый белко вый додекаэдрический каркас из 20 молекул KDPG альдолазы [108], на основе которого созданы ГКВВ. Структурной единицей данных везикул является трехдоменный полипептид, каждый из доменов ко торого осуществляет необходимую для сборки ГКВВ функцию. Первый домен действует как сигнал ми ристоилирования, который определяет мембранную локализацию конструкции; второй домен образует трехмерный белковый каркас, а третий рекрутиру ет эндосомальный комплекс сортировки ESCRT, не обходимый для транспорта, который отвечает за от почкование от мембраны. Второй важный компонент везикул, определяющий их способность проникать в клетки-мишени, - наличие на поверхности заяко ренного в мембране белка оболочки вируса везику лярного стоматита VSV-G, отвечающего за транспорт из эндосомы. При экспрессии этих конструкций в эу кариотических клетках образуются везикулы со сред ним радиусом 100 нм, покрытые клеточной мембраной и содержащие несколько белковых додекаэдров [109]. Полученные частицы способны загружать и достав лять необходимые вещества - низкомолекулярные соединения, РНК, пептиды, белки - в другие клетки, при этом защищая их от деградации. Кроме того, по верхность ГКВВ может быть дополнительно модифи цирована антителами, рецепторами или низкомоле кулярными лигандами для направленного транспорта. ПРИРОДНЫЕ ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ Внеклеточные везикулы (ВВ) - это липидные пу зырьки, которые секретируются практически всеми типами клеток. Будучи переносчиками РНК, мем бранных и цитоплазматических белков, липидов и углеводов, ВВ выполняют различные функции в организме, например, участвуют в межклеточной коммуникации. В зависимости от происхождения ВВ подразделяют на эктосомы (происходят от нейтро филов/моноцитов), простатосомы (выделены из се менной жидкости), вексосомы (ассоциированы с аде новирусным вектором) и т.д. По механизму биогенеза ВВ разделяют на экзосомы, микровезикулы и апоп тотические тельца [110]. Размер ВВ также варьиру ет, например, размер экзосом находится в пределах 40-120 нм, а микровезикул 50-1000 нм [111]. Благодаря таким свойствам, как биосовмести мость, неиммуногенность (при получении из подхо дящего типа клеток), а также способности проходить через ГЭБ, ВВ рассматривают как перспективное средство доставки различных молекул [112]. Однако лишь небольшая часть внутривенно введенных ВВ проникала в сердце и мозг мышей, а наибольшее ко личество обнаруживалось в селезенке и печени [113]. Следует отметить, что ВВ преимущественно обла дают отрицательным зарядом, что делает их фар макокинетику схожей с отрицательно заряженными липосомами [113]. Кроме того, фармакокинетика ВВ сильно зависит от набора белков и липидов на по верхности. Например, фосфатидилсерин, локали зованный на поверхности экзосом, способствует их связыванию с клетками, экспрессирующими на по верхности рецептор Timd4 (T-cell immunoglobulinand mucin-domain-containing molecule), что, в свою очередь, может указывать на усиленный захват таких экзосом макрофагами [114]. Изменение со става поверхностных белков ВВ также вызыва ет определенный эффект. Например, деградация интегринов-α6 и -β1 значительно уменьшала на копление ВВ в легочной ткани мыши. При этом такие физико-химические свойства ВВ, как размер и ζ-потенциал, практически не изменяются [115]. Таким образом, ВВ могут селективно накапливать ся в тканях в зависимости от набора лигандов на по верхности, что делает их перспективными носителя ми для направленной доставки. Методы выделения и очистки ВВ достаточно сложны и требуют дорогостоящего оборудования. Основными способами очистки являются ультрацен трифугирование, центрифугирование в градиенте плотности, ультрафильтрация, преципитация, а так же гель-фильтрация [116-119]. Помимо доставки терапевтических молекул, ВВ из разных типов клеток обладают различными свой ствами, которые могут использоваться в терапии са мых разнообразных заболеваний от ишемии и осте онекроза до рассеянного склероза и онкопатологии (рис. 3). Природные внеклеточные везикулы в модуляции иммунного ответа Прежде всего, ВВ способны оказывать значительное влияние на функционирование иммунной системы, они могут как стимулировать, так и подавлять им мунный ответ. Например, экзосомы из ДК, содержат молекулы ГКГС в комплексе с антигеном и способ ны вызывать специфический иммунный ответ [120]. Еще одна интересная особенность экзосом, произо шедших из ДК, - способность захватывать лиганды Толл-подобных рецепторов и активировать другие дендритные клетки, что также может стать причи ной иммунного ответа [121]. Известны также иммуносупрессивные ВВ. Например, мыши линии BALB/c, иммунизированные овальбумином, вырабатывают ВВ, которые индуци руют у мышей-реципиентов развитие специфиче ской иммунной толерантности к овальбумину [122]. Иммуносупрессивные ВВ считают потенциальными терапевтическими агентами при различных аутоим мунных и воспалительных заболеваниях. Например, везикулы, полученные от мезенхимальных стволо вых клеток (МСК), способны подавлять пролифера цию мононуклеарных клеток, полученных от мыши с экспериментальным аутоиммунным энцефаломи елитом (ЭАЭ), моделирующим рассеянный склероз [123]. Иммуномодулирующее действие внеклеточ ных везикул показано и на моделях воспалительных заболеваний кишечника и аутоиммунного гепатита [107, 108]. Опухолевые ВВ перспективны при создании про тивоопухолевых вакцин, поскольку они способны переносить белки, которые могут быть онкоанти генами. Например, в мышиной модели глиобласто мы доставка опухолеассоциированных антигенов к ДК была значительно более эффективной при ис пользовании экзосом, чем опухолевого лизата [124]. Однако опухолевые ВВ следует применять с большой осторожностью. Так, апоптотические ВВ из клеток глиобластомы могут индуцировать резистентность к терапии и более агрессивное поведение соседних опухолевых клеток за счет переноса компонентов сплайсосом [125]. Природные внеклеточные везикулы в регенеративной медицине Большие перспективы использования ВВ лежат в об ласти регенеративной медицины и трансплантологии. Показано непосредственное плейотропное регене ративное действие ВВ на различные органы и си стемы. Так, например, ВВ способны стимулировать рост сосудов, что может найти применение в транс плантологии, при ишемических нарушениях и язвах при диабетической стопе, а также для предотвраще ния остеонекроза [126-129]. Экзосомы, полученные от МСК, могут способствовать синтезу коллагена, регенерации хрящевой и мышечной ткани [130-132]. Описано также тканепротекторное действие ВВ, полученных от стволовых клеток. Например, благо даря активации Wnt/β-катенин сигнального каскада экзосомы от МСК способны усиливать выживаемость кардиомиоцитов даже в условиях цикличной ишемии и реперфузии [133]. На мышиной модели инфаркта миокарда показано, что экзосомы от эмбриональ ных стволовых клеток, содержащие различные ми кроРНК, улучшали функционирование сердечной мышцы, а также способствовали выживаемости ми оцитов [78]. Выявлено и нейропротекторное действие экзосом, полученных от различных МСК [134, 135]. Так, ВВ уменьшали глиоз, вызванный воспалением мозга при инъекции липополисахарида (ЛПС) незре лым мышам, уменьшали апоптоз нейронов, а также снижали выраженность структурных нарушений в белом веществе головного мозга [134]. Более того, под воздействием ВВ наблюдалось улучшение ре зультатов поведенческих тестов на пространствен ную память у мышей. Однако механизм нейропро текторного действия ВВ не определен [134]. Природные ВВ определенно имеют огромный те рапевтический потенциал. Однако из-за комплекс ного, часто малоизученного механизма действия, вероятной неоднородности состава, нежелательной иммуносупрессии в некоторых случаях, а также ак тивации пролиферативных сигнальных путей эти комплексы должны применяться с повышенной осто рожностью. ВЕЗИКУЛЫ, ЗАГРУЖЕННЫЕ ИСКУССТВЕННО Помимо перечисленных способов применения ВВ возможна их искусственная загрузка различными веществами. Основным преимуществом доставки те рапевтических препаратов с помощью везикул яв ляется их природное происхождение, что обуслав ливает низкую иммуногенность. Дополнительное преимущество ВВ - облегченный захват клетка ми-мишенями за счет различных рецептор-опос редованных взаимодействий между мембраной ВВ и клеткой [10]. Существуют две стратегии получения искусствен но загруженных везикул - совместная in vitro ин кубация ВВ и терапевтических агентов, чаще всего низкомолекулярных, а также создание генетических конструкций с последующей трансфекцией клеток с целью получения клеток-доноров, вырабатываю щих ВВ, загруженных необходимыми веществами. Как правило, для in vitro загрузки везикул исполь зуют малые липофильные молекулы, способные пассивно проникать в везикулы при совместной ин кубации. Показано, что инкубация раствора курку мина и экзосом в фосфатном буфере при комнатной температуре в течение 5 мин приводит к проник новению терапевтического агента внутрь ВВ [136]. Загруженные таким способом экзосомы усиливают противовоспалительный эффект куркумина, а так же ингибируют секрецию ИЛ-6 и ФНО-α у модель ных животных и обладают способностью проникать через ГЭБ. Этот метод использован также для за грузки ВВ такими цитостатическими агентами, как паклитаксел и доксирубицин [137]. Показано, что везикулы, в отличие от свободных форм тера певтических агентов, обладали способностью проникать через ГЭБ и распределяться в тканях мозга. Наблюдалось увеличение цитотоксической активно сти паклитаксела и доксирубицина в составе экзосом. Возможность снижения терапевтической дозы цито статиков при онкологических заболеваниях является несомненным преимуществом данной лекарствен ной формы, так как до сих пор не удается избавить ся от таких побочных эффектов этих препаратов, как системное воспаление и токсическое воздействие на органы [138]. Пассивный транспорт в экзосомы не всегда осу ществляется эффективно. Для увеличения эффек тивности загрузки используют различные моди фикации. Так, везикулы и терапевтические агенты инкубируют в присутствии поверхностно-актив ных веществ, например сапонина [139]. Механизм действия сапонина основан на образовании ком плекса с холестерином экзосом, что облегчает про никновение терапевтического агента [140]. Другой способ увеличения эффективности загрузки вези кул - применение электропорации. Использование этого метода позволило увеличить эффективность загрузки везикул доксирубицином до 20%. Широкого распространения достигло использование электро порации для загрузки везикул препаратами нукле иновых кислот. В качестве терапевтического агента в данном случае чаще всего используются миРНК и микроРНК. Так, разработаны экзосомы, несущие микроРНК, специфичные к мутантной форме GTP азы KRASG12D, которая способна спровоцировать раз витие рака поджелудочной железы [141]. Инкубация таких везикул с клетками рака поджелудочной же лезы приводит к снижению уровня мРНК KRASG12D. При тестировании препарата на мышах наблюдалось увеличение выживаемости, супрессия пролифера ции раковых клеток, снижение метастазирования по сравнению с контрольными животными. Помимо терапии онкологических заболеваний, комплек сы микроРНК-везикулы могут быть использованы при нейродегенеративных заболеваниях. Показана эффективность таких комплексов для снижения в культуре клеток количества α-синуклеина - бел ка, ассоциированного с болезнью Паркинсона [142]. После внутривенного введения мышам экзосом, на груженных миРНК, наблюдалось снижение концен трации мРНК α-синуклеина и уровня самого белка в исследованных областях мозга. Также созданы экзосомы, загруженные микроРНК к β-секретазе (BACE1). Продукт этого гена участвует в образо вании β-амилоидов, ассоциированных с болезнью Альцгеймера. Таргетинг нейронов экзосомами осу ществляли при помощи нейрон-специфичного RVG пептида, при этом удалось достичь снижения уров ня белка (62%) и синтеза мРНК (60%) BACE1 [112]. Несмотря на то что электропорация считается доста точно эффективным способом доставки нуклеиновых кислот в везикулы, этот метод имеет существенный недостаток, а именно, образование агрегатов РНК в везикулах [143]. Уменьшение агрегации наблюда ется при добавлении EDТА, а также при использова нии специальных полимерных электродов и кислого ацетатного буфера для электропорации. Для увеличения эффективности загрузки пред ложена принципиально отличная стратегия получе ния нагруженных везикул. Она заключалась в транс фекции клеток-доноров, секретирующих везикулы, рекомбинантными ДНК, кодирующими, например, микроРНК. Таким образом получают клетки, секре тирующие в среду нужную микроРНК [144]. Также удалось вызвать супрессию роста ксенотрансплан танта рака молочной железы при помощи адрес ной доставки микроРНК в везикулах, изолирован ных из культуры трансфицированных клеток [145]. При помощи трансформации клеток можно полу чить ВВ, несущие не только нуклеиновые кислоты, но и белки. При этом заякоренные в мембране белки переносятся в экзосомы путем слияния белка инте реса с участком миристилировавания и доменом, свя зывающим фосфатидилинозит-4,5-бисфосфат [146]. Таким образом, использование для адресной до ставки как немодифицированных, так и дополни тельно нагруженных терапевтическими агентами ВВ является современным и актуальным направлением исследований. ЗАКЛЮЧЕНИЕ Технология создания и загрузки наночастиц тера певтическими препаратами, разработанная во второй половине прошлого века, до сих пор остается одной из основных и, пожалуй, самой перспективной стра тегией доставки лекарственных агентов. На первых порах изучения липидоподобных наноконтейнеров основное внимание уделялось увеличению стабиль ности, биосовместимости и биораспределения искус ственно создаваемых наноносителей. Варьирование состава липидного слоя позволяет инкапсулировать как гидрофобные, так и гидрофильные соединения, благодаря чему можно подобрать свой способ транс портировки практически любого вещества. К пер спективным направлениям следует отнести приме нение генетических конструкций с контролируемой экспрессией [147], а также одновременную загрузку наноконтейнеров разными по механизму действия веществами, что позволяет существенно увеличить эффективность воздействия [148]. В настоящий мо мент приоритетным направлением является увели чение таргетности доставки. Данная задача решается как путем модификации уже давно известных искусственных наноконтейнеров, так и с помощью сравни тельно недавно открытых генетически кодируемых или природных внеклеточных везикул. Высокая био совместимость и биоразлагаемость дают им огромное преимущество перед другими искусственными на ночастицами. И хотя пока сложно оценить их ре альное фармацевтическое будущее во многом из-за относительно высокой себестоимости, нет сомнений в способности ВВ и ГКВВ эффективно доставлять лекарственные препараты in vivo. Таким образом, в ближайшие 10-20 лет можно с уверенностью ожи дать выхода на рынок перспективных препаратов, основанных на везикулярном транспорте, для тера пии тяжелых и плохо поддающихся лечению хро нических, аутоиммунных и онкологических заболе ваний.
Об авторах
А. В. Соколов
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Автор, ответственный за переписку.
Email: anna.kudriaeva@gmail.com
Россия
Н. Н. Костин
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Email: anna.kudriaeva@gmail.com
Россия
Л. А. Овчинникова
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Email: anna.kudriaeva@gmail.com
Россия
Я. А. Ломакин
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Email: anna.kudriaeva@gmail.com
Россия
А. А. Кудряева
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Email: anna.kudriaeva@gmail.com
Россия
Список литературы
- Yin H., Kauffman K.J., Anderson D.G. // Nat. Rev. Drug Discov. 2017, V.16, №6, P.387-399
- Ragelle H., Danhier F., Préat V., Langer R., Anderson D.G. // Expert Opin. Drug Deliv. 2017, V.14, №7, P.851-864
- Kreuter J. // Int. J. Pharm. 2007, V.331, №1, P.1-10
- Yu M., Wu J., Shi J., Farokhzad O.C. // J. Control. Release. 2016, V.240, P.24-37
- Shah M.A.A., Ali Z., Ahmad R., Qadri I., Fatima K., He N. // J. Nanosci. Nanotechnol. 2015, V.15, №1, P.41-53
- Nikitenko N.A., Prassolov V.S. // Acta Naturae. 2013, V.5, №3, P.35-53
- Liu Z., Jiao Y., Wang Y., Zhou C., Zhang Z. // Adv. Drug Deliv. Rev. 2008, V.60, №15, P.1650-1662
- Sahin S., Selek H., Ponchel G., Ercan M.T., Sargon M., Hincal A.A., Kas H.S. // J. Control. Release. 2002, V.82, №2-3, P.345-358
- Blanco E., Shen H., Ferrari M. // Nat. Biotechnol. 2015, V.33, №9, P.941-951
- György B., Hung M.E., Breakefield X.O., Leonard J.N. // Annu. Rev. Pharmacol. Toxicol. 2014, V.55, №1, P.439-464
- Bangham A.D. // Chem. Phys. Lipids. 1993, V.64, №1-3, P.275-85
- Vemuri S., Rhodes C.. // Pharm. Acta Helv. 1995, V.70, №2, P.95-111
- Kirby C., Gregoriadis G. // Nat. Biotechnol. 1984, V.2, №11, P.979-984
- Gruner S.M., Lenk R.P., Janoff A.S., Ostro N.J. // Biochemistry. 1985, V.24, №12, P.2833-2842
- Szoka F., Papahadjopoulos D., Papahadjopoulos D. // Proc. Natl. Acad. Sci. U. S. A. 1978, V.75, №9, P.4194-8
- Milsmann M.H., Schwendener R.A., Weder H.G. // Biochim. Biophys. Acta. 1978, V.512, №1, P.147-55
- Miller C.R., Bondurant B., McLean S.D., McGovern K.A., O’Brien D.F. // Biochemistry. 1998, V.37, №37, P.12875-12883
- Campbell R.B., Ying B., Kuesters G.M., Hemphill R. // J. Pharm. Sci. 2009, V.98, №2, P.411-429
- Broekgaarden M., de Kroon A.I.P.M., van Gulik T.M., Heger M. // Curr. Med. Chem. 2014, V.21, №3, P.377-91
- Lowe S.W., Ruley H.E., Jacks T., Housman D.E. // Cell. 1993, V.74, №6, P.957-967
- Guo J., Ping Q., Jiang G., Huang L., Tong Y. // Int. J. Pharm. 2003, V.260, №2, P.167-173
- Allen C., Dos Santos N., Gallagher R., Chiu G.N.C., Shu Y., Li W.M., Johnstone S.A., Janoff A.S., Mayer L.D., Webb M.S. // Biosci. Rep. 2002, V.22, №2, P.225-50
- Suk J.S., Xu Q., Kim N., Hanes J., Ensign L.M. // Adv. Drug Deliv. Rev. 2016, V.99, P.28-51
- Sharma A., Sharma U.S. // Int. J. Pharm. 1997, V.154, №2, P.123-140
- Bergström K., Osterberg E., Holmberg K., Hoffman A.S., Schuman T.P., Kozlowski A., Harris J.H. // J. Biomater. Sci. Polym. Ed. 1994, V.6, №2, P.123-32
- Pasut G., Paolino D., Celia C., Mero A., Joseph A.S., Wolfram J., Cosco D., Schiavon O., Shen H., Fresta M. // J. Control. Release. 2015, V.199, P.106-113
- Kabilova T., Shmendel E., Gladkikh D., Morozova N., Maslov M., Chernolovskaya E., Vlassov V., Zenkova M., Kabilova T., Shmendel E. // Molecules. 2018, V.23, №12, P.3101
- Zelepukin I. V., Yaremenko A. V., Shipunova V.O., Babenyshev A. V., Balalaeva I. V., Nikitin P.I., Deyev S.M., Nikitin M.P. // Nanoscale. 2019, V.11, №4, P.1636-1646
- Markov O.O., Mironova N.L., Maslov M.A., Petukhov I.A., Morozova N.G., Vlassov V. V., Zenkova M.A. // J. Control. Release. 2012, V.160, №2, P.200-210
- Markov O. V., Mironova N.L., Shmendel E. V., Serikov R.N., Morozova N.G., Maslov M.A., Vlassov V. V., Zenkova M.A. // J. Control. Release. 2015, V.213, P.45-56
- Deyev S., Proshkina G., Baryshnikova O., Ryabova A., Avishai G., Katrivas L., Giannini C., Levi-Kalisman Y., Kotlyar A. // Eur. J. Pharm. Biopharm. 2018, V.130, P.296-305
- Matsumura Y., Gotoh M., Muro K., Yamada Y., Shirao K., Shimada Y., Okuwa M., Matsumoto S., Miyata Y., Ohkura H. // Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2004, V.15, №3, P.517-25
- Espelin C.W., Leonard S.C., Geretti E., Wickham T.J., Hendriks B.S. // Cancer Research 2016, V.76, №6, P.1517-1527
- Sankhala K. K. // J. Clin. Oncol. 2009, V.27, P.2535-2535
- clinicaltrials.gov
- Torchilin V.P. // Handbook of experimental pharmacology. 2010, P.3-53
- Zhou G., Wilson G., Hebbard L., Duan W., Liddle C., George J., Qiao L. // Oncotarget. 2016, V.7, №12, P.13446-63
- Bobo D., Robinson K.J., Islam J., Thurecht K.J., Corrie S.R. // Pharm. Res. 2016, V.33, №10, P.2373-2387
- Barenholz Y. (Chezy). // J. Control. Release. 2012, V.160, №2, P.117-134
- Stepanov A., Lomakin Y., Gabibov A., Belogurov A. // Curr. Med. Chem. 2017, V.24, №17, P.1761-1771
- Belogurov A.A., Stepanov A. V., Smirnov I. V., Melamed D., Bacon A., Mamedov A.E., Boitsov V.M., Sashchenko L.P., Ponomarenko N.A., Sharanova S.N. // FASEB J. 2013, V.27, №1, P.222-231
- Belogurov A., Zakharov K., Lomakin Y., Surkov K., Avtushenko S., Kruglyakov P., Smirnov I., Makshakov G., Lockshin C., Gregoriadis G. // Neurotherapeutics. 2016, V.13, №4, P.895-904
- Lomakin Y., Belogurov A., Glagoleva I., Stepanov A., Zakharov K., Okunola J., Smirnov I., Genkin D., Gabibov A. // Mediators Inflamm. 2016, V.2016, P.1-8
- Ivanova V. V., Khaiboullina S.F., Gomzikova M.O., Martynova E. V., Ferreira A.M., Garanina E.E., Sakhapov D.I., Lomakin Y.A., Khaibullin T.I., Granatov E. V. // Front. Immunol. 2017, V.8, P.1335
- Bernasconi V., Norling K., Bally M., Höök F., Lycke N.Y. // J. Immunol. Res. 2016, V.2016, P.1-16
- Nisini R., Poerio N., Mariotti S., De Santis F., Fraziano M. // Front. Immunol. 2018, V.9, P.155
- Bartelds R., Nematollahi M.H., Pols T., Stuart M.C.A., Pardakhty A., Asadikaram G., Poolman B. // PLoS One. 2018, V.13, №4, e0194179
- Rajera R., Nagpal K., Singh S.K., Mishra D.N. // Biol. Pharm. Bull. 2011, V.34, №7, P.945-53
- Kaur D., Kumar S. // J. Drug Deliv. Ther. 2018, V.8, №5, P.35-43
- Moghassemi S., Hadjizadeh A. // J. Control. Release. 2014, V.185, P.22-36
- Shilpa S., Srinivasan B.P., Chauhan M. // Int. J. Drug Deliv. 2011, V.3, №1, P.14-24
- Zeng W., Li Q., Wan T., Liu C., Pan W., Wu Z., Zhang G., Pan J., Qin M., Lin Y. // Colloids Surfaces B Biointerfaces. 2016, V.141, P.28-35
- Marianecci C., Di Marzio L., Rinaldi F., Celia C., Paolino D., Alhaique F., Esposito S., Carafa M. // Adv. Colloid Interface Sci. 2014, V.205, P.187-206
- Touitou E. // US Pat. 5,716,638. 1996. 1996
- Yang L., Wu L., Wu D., Shi D., Wang T., Zhu X. // Int. J. Nanomedicine. 2017, V.12, P.3357-3364
- Bansal S., Prasad Kashyap C., Aggarwal G., Harikumar S. // IJRPC. 2012, V.2, №3, P.704-713
- Sankar V., Ramesh S., Siram K. // InTech. 2018
- Duangjit S., Opanasopit P., Rojanarata T., Ngawhirunpat T. // Adv. Mater. Res. 2011, V.194-196, P.537-540
- Chen J., Lu W.L., Gu W., Lu S.S., Chen Z.P., Cai B.C. // Expert Opin. Drug Deliv. 2013, V.10, №6, P.845-856
- Gupta A., Aggarwal G., Singla S., Arora R. // Sci. Pharm. 2012, V.80, №4, P.1061-80
- Irfan M., Verma S., Ram A. // Asian J. Pharm. Clin. Res. 2012, V.5, №3, P.162-165
- Ghannoum M., Isham N., Herbert J., Henry W., Yurdakul S. // J. Clin. Microbiol. 2011, V.49, №5, P.1716-20
- Lu K., Xie S., Han S., Zhang J., Chang X., Chao J., Huang Q., Yuan Q., Lin H., Xu L. // J. Transl. Med. 2014, V.12, №1, P.72
- May J.P., Li S.D. // Expert Opin. Drug Deliv. 2013, V.10, №4, P.511-527
- Nobuto H., Sugita T., Kubo T., Shimose S., Yasunaga Y., Murakami T., Ochi M. // Int. J. Cancer. 2004, V.109, №4, P.627-635
- Sawant R.R., Torchilin V.P. // Soft Matter. 2010, V.6, №17, P.4026
- Khulbe P. // In: Novel Approaches for Drug Delivery. 2017 2017
- Wong H.L., Bendayan R., Rauth A.M., Li Y., Wu X.Y. // Adv. Drug Deliv. Rev. 2007, V.59, №6, P.491-504
- Mukherjee S., Ray S., Thakur R. // Indian J. Pharm. Sci. 2009, V.71, №4, P.349
- Mehnert W., Mäder K. // Adv. Drug Deliv. Rev. 2001, V.47, №2-3, P.165-96
- Wissing S.., Kayser O., Müller R. // Adv. Drug Deliv. Rev. 2004, V.56, №9, P.1257-1272
- Müller R.H., Mäder K., Gohla S. // Eur. J. Pharm. Biopharm. 2000, V.50, №1, P.161-77
- Maheswaran A., Brindha P., Mullaicharam A.R., Masilamani K. // Int. J. Pharm. Sci. Rev. Res. 2013, V.23, №1, P.295-301
- Olbrich C., Gessner A., Schröder W., Kayser O., Müller R.H. // J. Control. Release. 2004, V.96, №3, P.425-435
- Dolatabadi J.E.N., Valizadeh H., Hamishehkar H. // Adv. Pharm. Bull. 2015, V.5, №2, P.151-159
- zur Mühlen A., Schwarz C., Mehnert W. // Eur. J. Pharm. Biopharm. 1998, V.45, №2, P.149-55
- Müller R.H., Radtke M., Wissing S.A. // Adv. Drug Deliv. Rev. 2002, V.54, P.S131-S155
- Li Q., Cai T., Huang Y., Xia X., Cole S., Cai Y. // Nanomaterials. 2017, V.7, №6, P.122
- Iqbal M.A., Md S., Sahni J.K., Baboota S., Dang S., Ali J. // J. Drug Target. 2012, V.20, №10, P.813-830
- Khan S., Baboota S., Ali J., Khan S., Narang R., Narang J. // Int. J. Pharm. Investig. 2015, V.5, №4, P.182
- Czajkowska-Kośnik A., Szekalska M., Winnicka K. // Pharmacol. Reports. 2019, V.71, №1, P.156-166
- Hadinoto K., Sundaresan A., Cheow W.S. // Eur. J. Pharm. Biopharm. 2013, V.85, №3, P.427-443
- Chan J.M., Zhang L., Yuet K.P., Liao G., Rhee J.W., Langer R., Farokhzad O.C. // Biomaterials. 2009, V.30, №8, P.1627-1634
- Yoo J.W., Irvine D.J., Discher D.E., Mitragotri S. // Nat. Rev. Drug Discov. 2011, V.10, №7, P.521-535
- Zhang P., Liu G., Chen X. // Nano Today. 2017, V.13, P.7-9
- Almeida J., Edwards D.C., Brand C., Heath T. // Lancet. 1975, V.306, №7941, P.899-901
- de Jonge J., Leenhouts J.M., Holtrop M., Schoen P., Scherrer P., Cullis P.R., Wilschut J., Huckriede A. // Biochem. J. 2007, V.405, №1, P.41-9
- Kuroda S., Liu Q., Jung J., Iijima M., Yoshimoto N., Niimi T., Maturana A., Shin S.H., Jeong S.Y., Choi E.K. // Int. J. Nanomedicine. 2015, V.10, №1, P.4159
- Liu H., Tu Z., Feng F., Shi H., Chen K., Xu X. // Acta Pharm. 2015, V.65, №2, P.105-116
- Mohammadzadeh Y., Rasouli N., Aref M.H.S., Tabib N.S.S., Abdoli A., Biglari P., Saleh M., Tabatabaeian M., Kheiri M.T., Jamali A. // Biotechnol. Lett. 2016, V.38, №8, P.1321-1329
- Bovier P.A. // Expert Rev. Vaccines. 2008, V.7, №8, P.1141-1150
- Blom R.A.M., Amacker M., van Dijk R.M., Moser C., Stumbles P.A., Blank F., von Garnier C. // Front. Immunol. 2017, V.8, P.359
- Kaneda Y. // Adv. Drug Deliv. Rev. 2012, V.64, №8, P.730-738
- Leroux-Roels G., Maes C., Clement F., van Engelenburg F., van den Dobbelsteen M., Adler M., Amacker M., Lopalco L., Bomsel M., Chalifour A. // PLoS One. 2013, V.8, №2, e55438
- Wang M., Gao Z., Zhang Y., Pan L. // Appl. Microbiol. Biotechnol. 2016, V.100, №13, P.5691-5701
- Bron P.A., Kleerebezem M. // Front. Microbiol. 2018, V.9, P.1821
- Forbes N.S. // Nat. Rev. Cancer. 2010, V.10, №11, P.785-94
- Hosseinidoust Z., Mostaghaci B., Yasa O., Park B.W., Singh A.V., Sitti M. // Adv. Drug Deliv. Rev. 2016, V.106, PtA, P.27-44
- Langemann T., Koller V.J., Muhammad A., Kudela P., Mayr U.B., Lubitz W. // Bioeng. Bugs. 2010, V.1, №5, P.326-36
- Lubitz P., Mayr U.B., Lubitz W. // Springer, New York, NY. 2009. 2009, P.159-170
- Farjadian F., Moghoofei M., Mirkiani S., Ghasemi A., Rabiee N., Hadifar S., Beyzavi A., Karimi M., Hamblin M.R. // Biotechnol. Adv. 2018, V.36, №4, P.968-985
- Kudela P., Koller V.J., Lubitz W. // Vaccine. 2010, V.28, №36, P.5760-5767
- Chen Z., Hu Q., Gu Z. // Acc. Chem. Res. 2018, V.51, №3, P.668-677
- Villa C.H., Anselmo A.C., Mitragotri S., Muzykantov V. // Adv. Drug Deliv. Rev. 2016, V.106, PtA, P.88-103
- Yan J., Yu J., Wang C., Gu Z. // Small Methods. 2017, V.1, №12, P.1700270
- Stuckey D.W., Shah K. // Nat. Rev. Cancer. 2014, V.14, №10, P.683-691
- Ngandeu Neubi G.M., Opoku-Damoah Y., Gu X., Han Y., Zhou J., Ding Y. // Biomater. Sci. 2018, V.6, №5, P.958-973
- Hsia Y., Bale J.B., Gonen S., Shi D., Sheffler W., Fong K.K., Nattermann U., Xu C., Huang P.S., Ravichandran R. // Nature 2016, V.535, №7610, P.136-139
- Votteler J., Ogohara C., Yi S., Hsia Y., Nattermann U., Belnap D.M., King N.P., Sundquist W.I. // Nature 2016, V.540, №7632, P.292-295
- Gusachenko O.N., Zenkova M.A., Vlassov V. V. // Biochem. 2013, V.78, №1, P.1-7
- EL Andaloussi S., Mäger I., Breakefield X.O., Wood M. J.A. // Nat. Rev. Drug Discov. 2013, V.12, №5, P.347-357
- Loughmiller J., Klintworth G. // Nat. Biotechnol. 2011, V.29, №4, P.306-309
- Lai C.P., Mardini O., Ericsson M., Prabhakar S., Maguire C., Chen J.W., Tannous B.A., Breakefield X.O. // ACS Nano. 2014, V.8, №1, P.483-494
- Miyanishi M., Tada K., Koike M., Uchiyama Y., Kitamura T., Nagata S. // Nature 2007, V.450, №7168, P.435-439
- Charoenviriyakul C., Takahashi Y., Morishita M., Nishikawa M., Takakura Y. // Mol. Pharm. 2018, V.15, №3, P.1073-1080
- Merchant M.L., Rood I.M., Deegens J.K.J., Klein J.B. // Nat. Rev. Nephrol. 2017, V.13, №12, P.731-749
- Vaswani K., Koh Y.Q., Almughlliq F.B., Peiris H.N., Mitchell M.D. // Reprod. Biol. 2017, V.17, №4, P.341-348
- Foers A.D., Chatfield S., Dagley L.F., Scicluna B.J., Webb A.I., Cheng L., Hill A.F., Wicks I.P., Pang K.C. // J. Extracell. Vesicles. 2018, V.7, №1, P.1490145
- Lane R.E., Korbie D., Trau M., Hill M.M. // Methods Mol. Biol. 2017, V.1660, P.111-130
- Montecalvo A., Shufesky W.J., Stolz D.B., Sullivan M.G., Wang Z., Divito S.J., Papworth G.D., Watkins S.C., Robbins P.D., Larregina A.T. // J. Immunol. 2008, V.180, №5, P.3081-90
- Sobo-Vujanovic A., Munich S., Vujanovic N.L. // Cell. Immunol. 2014, V.289, №1-2, P.119-127
- Östman S., Taube M., Telemo E. // Immunology. 2005, V.116, №4, P.464-476
- Mokarizadeh A., Delirezh N., Morshedi A., Mosayebi G., Farshid A.A., Mardani K. // Immunol. Lett. 2012. V. 147. № 1-2. 2012, V.147, №1-2, P.47-54
- Liu H., Chen L., Liu J., Meng H., Zhang R., Ma L., Wu L., Yu S., Shi F., Li Y. // Cancer Lett. 2017, V.411, P.182-190
- Pavlyukov M.S., Yu H., Bastola S., Minata M., Shender V.O., Lee Y., Zhang S., Wang J., Komarova S., Wang J. // Cancer Cell. 2018, V.34, №1, P.119.e10-135.e10
- Hu Y., Rao S.S., Wang Z.X., Cao J., Tan Y.J., Luo J., Li H.M., Zhang W.S., Chen C.Y., Xie H. // Theranostics. 2018, V.8, №1, P.169-184
- Komaki M., Numata Y., Morioka C., Honda I., Tooi M., Yokoyama N., Ayame H., Iwasaki K., Taki A., Oshima N. // Stem Cell Res. Ther. 2017, V.8, №1, P.219
- Li X., Xie X., Lian W., Shi R., Han S., Zhang H., Lu L., Li M. // Exp. Mol. Med. 2018, V.50, №4, P.29
- Liu X., Li Q., Niu X., Hu B., Chen S., Song W., Ding J., Zhang C., Wang Y. // Int. J. Biol. Sci. 2017, V.13, №2, P.232-244
- Zhang J., Guan J., Niu X., Hu G., Guo S., Li Q., Xie Z., Zhang C., Wang Y. // J. Transl. Med. 2015, V.13, №1, P.49
- Zhang S., Chu W.C., Lai R.C., Lim S.K., Hui J.H.P., Toh W.S. // Osteoarthr. Cartil. 2016, V.24, №12, P.2135-2140
- Nakamura Y., Miyaki S., Ishitobi H., Matsuyama S., Nakasa T., Kamei N., Akimoto T., Higashi Y., Ochi M. // FEBS Lett. 2015, V.589, №11, P.1257-1265
- Cui X., He Z., Liang Z., Chen Z., Wang H., Zhang J. // J. Cardiovasc. Pharmacol. 2017, V.70, №4, P.225-231
- Drommelschmidt K., Serdar M., Bendix I., Herz J., Bertling F., Prager S., Keller M., Ludwig A.K., Duhan V., Radtke S. // Brain. Behav. Immun. 2017, V.60, P.220-232
- Liu W., Wang Y., Gong F., Rong Y., Luo Y., Tang P., Zhou Z., Zhou Z., Xu T., Jiang T. // J. Neurotrauma. 2018, neu.2018.5835
- Zhuang X., Xiang X., Grizzle W., Sun D., Zhang S., Axtell R.C., Ju S., Mu J., Zhang L., Steinman L. // Molecular Therapy 2011, V.19, №10, P.1769-1779
- Yang T., Martin P., Fogarty B., Brown A., Schurman K., Phipps R., Yin V.P., Lockman P., Bai S. // Pharm. Res. 2015, V.32, №6, P.2003-2014
- Wang L., Chen Q., Qi H., Wang C., Wang C., Zhang J., Dong L. // Cancer Research 2016, V.76, №22, P.6631-6642
- Fuhrmann G., Serio A., Mazo M., Nair R., Stevens M.M. // J. Control. Release. 2015, V.205, P.35-44
- Wassler M., Jonasson I., Persson R., Fries E. // Biochem. J. 2015, V.247, №2, P.407-415
- Kamerkar S., Lebleu V.S., Sugimoto H., Yang S., Ruivo C.F., Melo S.A., Lee J.J., Kalluri R. // Nature 2017, V.546, №7659, P.498-503
- Cooper J.M., Wiklander P.B.O., Nordin J.Z., Al-Shawi R., Wood M.J., Vithlani M., Schapira A.H.V., Simons J.P., El-Andaloussi S., Alvarez-Erviti L. // Mov. Disord. 2014, V.29, №12, P.1476-1485
- Kooijmans S.A.A., Stremersch S., Braeckmans K., De Smedt S.C., Hendrix A., Wood M.J.A., Schiffelers R.M., Raemdonck K., Vader P. // J. Control. Release. 2013, V.172, №1, P.229-238
- Kosaka N., Iguchi H., Yoshioka Y., Takeshita F., Matsuki Y., Ochiya T. // J. Biol. Chem. 2010, V.285, №23, P.17442-17452
- Ohno S.I., Takanashi M., Sudo K., Ueda S., Ishikawa A., Matsuyama N., Fujita K., Mizutani T., Ohgi T., Ochiya T. // Molecular Therapy 2013, V.21, №1, P.185-191
- Shen B., Wu N., Yang M., Gould S.J. // J. Biol. Chem. 2011, V.286, №16, P.14383-14395
- Glinka E.M., Edelweiss E.F., Sapozhnikov A.M., Deyev S.M. // Gene. 2006, V.366, №1, P.97-103
- Guryev E.L., Volodina N.O., Shilyagina N.Y., Gudkov S. V., Balalaeva I. V., Volovetskiy A.B., Lyubeshkin A. V., Sen’ A. V., Ermilov S.A., Vodeneev V.A. // Proc. Natl. Acad. Sci. U. S. A. 2018, V.115, №39, P.9690-9695
Дополнительные файлы