Эволюция таргетной радионуклидной диагностики HER2-позитивного рака молочной железы
- Авторы: Брагина О.Д.1,2, Деев С.М.2,3, Чернов В.И.1,2, Толмачев В.М.2,4
-
Учреждения:
- Томский национальный исследовательский медицинский центр РАН
- Национальный исследовательский Томский политехнический университет
- Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
- Упсальский университет
- Выпуск: Том 14, № 2 (2022)
- Страницы: 4-15
- Раздел: Обзоры
- Дата подачи: 20.10.2021
- Дата принятия к публикации: 16.03.2022
- Дата публикации: 21.07.2022
- URL: https://actanaturae.ru/2075-8251/article/view/11611
- DOI: https://doi.org/10.32607/actanaturae.11611
- ID: 11611
Цитировать
Аннотация
Представленный обзор посвящен «клинической» эволюции радионуклидной диагностики HER2-позитивного рака молочной железы с использованием в качестве «нацеливающего» модуля различных структур – от «полноразмерных» антител до новой группы синтетических белков небольшого размера – альтернативных каркасных белков. Эта тематика особенно актуальна в связи с существующими проблемами выявления злокачественных опухолей молочной железы с гиперэкспрессией HER2/neu, что во многих случаях ведет к назначению неадекватного системного лечения у пациентов этой категории. Результаты клинических исследований радиофармпрепаратов на основе молекул аффибоди, адаптов и дарпинов для ОФЭКТ и ПЭТ продемонстрировали их хорошую переносимость, быстрое выведение из организма и возможность дифференцировки опухолевых очагов в зависимости от статуса рецептора эпидермального фактора роста HER2/neu, что свидетельствует о перспективности таргетной радионуклидной диагностики и необходимости продолжения исследований в данном направлении.
Полный текст
ВВЕДЕНИЕ
Ежегодно в мире диагностируется более 10 млн новых случаев злокачественных образований, при этом около 7.6 млн человек умирают от данной патологии [1]. На этом фоне в структуре онкологических заболеваний среди женского населения лидирующие позиции по показателям заболеваемости и смертности уверенно занимает рак молочной железы (РМЖ) [2]. Так, по данным ESMO (European Society for Medical Oncology) Guidelines, в 2018 году во всем мире насчитывалось около 2.1 млн новых случаев РМЖ (почти каждый четвертый случай), при этом 630 000 больных умерли от данной патологии [3]. На территории Российской Федерации в 2019 году зарегистрировано 70682 случая РМЖ (20.9% в структуре онкологических заболеваний женского населения); показатель смертности при этом составил 1.6% [4]. В структуре смертности женского населения РМЖ также находится на первом месте – 16.2% [5].
Несмотря на широкую распространенность РМЖ, начиная с 2012 года увеличивается продолжительность жизни больных, которым диагноз РМЖ был поставлен в течение последних 5 лет и более (пациентки с признаками или без признаков болезни). Так, в Российской Федерации этот показатель составляет 59.8% [6]. Подобные результаты прежде всего обусловлены улучшением диагностических алгоритмов и совершенствованием как локального, так и системного лечения [7]. В частности, в последнее время в терапии онкологических заболеваний широко используется концепция персонифицированной медицины, подразумевающая назначение лечения согласно индивидуальным характеристикам каждого пациента и учет предполагаемого ответа на него [8]. В настоящее время в онкологической практике широко применяется концепция персонифицированной медицины. К одному из наиболее стремительно развивающихся направлений персонифицированной медицины относится тераностика, которая объединяет понятия «терапия» и «диагностика» и подразумевает использование агентов или методов, включающих диагностическую визуализацию и таргетную терапию [9]. При этом «визуализирующий» этап тераностического подхода состоит из обработки изображений, визуализации биологической мишени и идентификации подгруппы пациентов, у которых ожидается наибольшая эффективность планируемого лечения; последующий же «терапевтический» этап представляет собой введение лекарственного агента, воздействующего на выявленные ранее мишени [10]. Основными целями данной стратегии являются повышение эффективности проводимой терапии, улучшение показателей выживаемости онкологических больных, снижение побочных реакций и вытекающее из этого уменьшение общих затрат [11]. Стремительный прогресс в развитии тераностического подхода во многом обусловлен получением новых данных о молекулярных основах канцерогенеза, созданием технологий изготовления новых биологических агентов, а также улучшением качества и точности диагностических приборов [12].
РЕЦЕПТОР ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА HER2/neu
Одной из наиболее изученных молекулярных мишеней, локализованных на поверхности опухолевых клеток, является рецептор эпидермального фактора роста 2 (HER2/neu), относящийся к семейству трансмембранных рецепторов тирозинкиназ EGF (рецептор эпидермального фактора роста: ErbB1/HER1; ErbB2/HER2; ErbB3/HER3; ErbB4/HER4) и регулирующий процессы клеточного деления, роста, дифференцировки, пролиферации, миграции и апоптоза [13, 14]. Гиперэкспрессия HER2/neu, выявляемая при раке желудка, яичников, простаты, легких, мочевого пузыря и др., наиболее часто встречается при инвазивном раке молочной железы [15, 16]. В большинстве случаев повышенная экспрессия HER2/neu в опухолевой клетке обусловлена амплификацией гена ERBB2, расположенного в локусе 17q12 хромосомы, и сопряжена со специфическими изменениями в некоторых локусах других хромосом (11q13, 16q22–q24 и 18q21) [17].
Гиперэкспрессия HER2/neu и/или амплификация гена ERBB2 встречается в 15–20% случаев РМЖ и считается неблагоприятным прогностическим фактором, она проявляется агрессивным течением заболевания, а также низкими показателями общей и безрецидивной выживаемости [18, 19]. Согласно российским и международным клиническим рекомендациям, в случае опухолей, характеризующихся высокой экспрессией данного рецептора, требуется назначение направленного (таргетного) лечения с использованием препаратов, применяемых как в монорежиме, так и в комбинации с химиотерапией [20]. «Золотым» стандартом лечения HER2-позитивного рака молочной железы остается таргетный препарат герцептин, содержащий гуманизированное моноклональное антитело (мкАТ) трастузумаб, – первое одобренное FDA (Food and Drug Administration, США) в 1998 году соединение для подавления функции HER2/neu. Использование трастузумаба в терапии метастатического рака молочной железы в сочетании с таксанами привело к увеличению частоты ответа, показателей выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) [21]. Для проведения таргетной терапии требуется тщательный отбор кандидатов [22]. В настоящее время для определения статуса HER2/neu разработаны несколько методик, оценивающих экспрессию маркера на уровне белка, ДНК и РНК. Наибольшее распространение среди них получили одобренные FDA иммуногистохимическое исследование (ИГХ) и флуоресцентная гибридизация in situ (FISH) [23].
Иммуногистохимическое исследование представляет собой широко используемый метод оценки экспрессии HER2/neu на поверхности опухолевых клеток в фиксированных формалином образцах рака молочной железы [24]. Согласно рекомендациям Американского общества клинической онкологии (ASCO) от 2018 года, негативными считаются случаи категории 0 и 1+, положительными – категории «3+». Таргетная терапия назначается больным, у которых гиперэкспрессия рецептора соответствует оценке «3+». Cлучаи «2+» относятся к «сомнительным» и требуют проведения флуоресцентной (FISH) гибридизации in situ для определения амплификации гена ERBB2 [25].
Несмотря на доступность и относительно низкую стоимость исследования, на результаты ИГХ могут значительно влиять многочисленные факторы, такие, как методика приготовления препарата (продолжительность фиксации и используемый фиксатор), характеристика используемых антител (производитель), квалификация персонала и интерпретация полученных результатов, преимущественно случаев с оценкой 2+ [26].
Флуоресцентная гибридизация in situ (FISH) – цитогенетический метод, в котором используют флуоресцентно меченные зонды для обнаружения специфических последовательностей ДНК в фиксированных формалином образцах ткани рака молочной железы. В образцах рака молочной железы FISH применяют для количественного определения числа копий гена ERBB2 в ядрах опухолевых клеток; амплификация считается положительной при наличии среднего количества копий гена ERBB2 и среднем числе центромер хромосомы 17 в клетке более 2.2. Несомненными преимуществами флуоресцентной гибридизации in situ являются более объективные и количественные результаты по сравнению с ИГХ, что, вероятно, обусловлено большей стабильностью ДНК и наличием внутренних контролей, состоящих из неамплифицированных сигналов в неопухолевых клетках (эпителиальные клетки протоков и стромальные клетки), прилегающих к опухоли [27].
FISH – это очень надежный метод оценки амплификации гена ERBB2, однако на его выполнение требуется в 9 раз больше времени (36 ч против 4 ч), его стоимость в несколько раз выше, чем у стандартного иммуногистохимического анализа, для обнаружения и распознавания сигналов необходимо дорогое оборудование, а также высококвалифицированный персонал для обработки полученных результатов [28].
С клинической точки зрения существенным недостатком «традиционных» методов определения статуса HER2/neu на диагностическом этапе является невозможность одномоментной оценки распространенности опухолевого процесса in vivo с анализом молекулярных характеристик выявленных опухолевых очагов до назначения специального лечения [29]. Этот факт имеет особое значение в аспекте все чаще обсуждаемой гетерогенности экспрессии HER2/neu в первичной опухоли, регионарных и отдаленных метастатических очагах, что может встречаться, согласно данным различных анализов, в 6–48% случаев [30]. Практически в 20% случаев рака молочной железы выявлено несоответствие статуса HER2/neu в первичной опухоли и пораженных лимфатических узлах [31]. В случае метастатических очагов в удаленных органах и тканях такое несоответствие составило, согласно Lower и соавт., 14.3%, тогда как по данным Turner и соавт. этот показатель достигал 34% [32, 33]. Наиболее существенное значение этот факт имеет при метастатическом раке молочной железы, который характеризуется длительным и «волнообразным» течением, что требует нескольких этапов и видов системного лечения. Выполнение же биопсии или хирургического забора материала из существующих и/или вновь выявленных метастатических очагов для оптимизации тактики лечения порой технически невыполнимо либо может повлечь за собой серьезные осложнения [30].
Нерешенной остается и проблема внутриопухолевой гетерогенности, которая встречается в 40% случаев рака молочной железы и может быть представлена сосуществованием множества субпопуляций клеток с различной экспрессией HER2/neu в одной и той же опухоли [34, 35]. Недавние исследования показали, что у больных с HER2-позитивным РМЖ с внутриопухолевой гетерогенностью экспрессии рецептора показатель безрецидивной выживаемости (БРВ), а также эффективность таргетной терапии трастузумабом снижены по сравнению с опухолями с гомогенной экспрессией [36]. Несмотря на это, пока не изучена связь между гетерогенностью HER2 и отдаленными результатами лечения больных после хирургического вмешательства. Все это обуславливает необходимость разработки новых дополнительных диагностических методик для оптимизации процесса диагностики у больных раком молочной железы [37].
РАДИОНУКЛИДНЫЕ МЕТОДЫ ДИАГНОСТИКИ HER2-ПОЗИТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
В последние годы изучаются возможности выявления злокачественных новообразований с помощью таргетных радионуклидных методов [38]. Одним из наиболее изучаемых подходов к связыванию с рецептором HER2/neu является использование меченых моноклональных антител (мкАТ) [39]. Диагностические радиофармпрепараты (РФП), применяемые в онкологической практике, относятся к содержащим радионуклиды препаратам для однофотонной эмиссионной компьютерной томографии (ОФЭКТ) (γ-излучатели с энергией в пределах 100–200 кэВ и периодами полураспада от нескольких минут до нескольких суток) и позитронно-эмиссионной томографии (ПЭТ) (β+-излучатели с периодами полураспада от нескольких секунд до нескольких часов) [40]. Сравнительная характеристика радиоизотопов, используемых для радионуклидной визуализации, представлена в табл. 1.
Таблица 1. Радиоизотопы для проведения радионуклидной диагностики с использованием ПЭТ или ОФЭКТ
Радиоизотопы | Период | Способ получения |
Радиоизотопы для ОФЭКТ | ||
99mTc | 6.01 ч | Генератор |
123I | 13.3 ч | Циклотрон |
111In | 2.8 дня | Циклотрон |
Радиоизотопы для ПЭТ | ||
15O | 2.03 мин | Циклотрон |
13N | 9.97 мин | Циклотрон |
11C | 20.4 мин | Циклотрон |
68Ga | 67.7 мин | Генератор |
18F | 109.8 мин | Циклотрон |
64Cu | 12.7 ч | Циклотрон |
76Br | 16.2 ч | Циклотрон |
89Zr | 78.4 ч | Циклотрон |
124I | 100 ч | Циклотрон |
ОФЭКТ получила широкое распространение во многом благодаря своей низкой себестоимости, в то время как ПЭТ-диагностика, имеющая более высокую стоимость, обеспечивает значительно лучшую чувствительность, пространственное разрешение и точность количественного определения. Недавнее внедрение сканеров для ОФЭКТ-диагностики на основе теллурида кадмия и цинка позволяет значительно увеличить чувствительность и разрешение камеры [41, 42].
По сравнению с «инвазивными» методами диагностики радионуклидная визуализация онкологических заболеваний со cверхэкспрессией HER2/neu имеет ряд существенных преимуществ, к которым относятся неинвазивный характер исследования с возможностью проведения повторных исследований [43], оценка экспрессии маркера в динамике на фоне проводимого лечения; одномоментная визуализация всего тела больного с оценкой экспрессии рецептора HER/neu в первичной опухоли и метастатических очагах, а также совершенствование диагностического оборудования, проявляющееся в разработке аппаратов, сочетающих модули для радионуклидных исследований и модули для анатомической визуализации метастатических очагов (компьютерная томография и магнитно-резонансная томография) [44].
В настоящее время известны несколько классов «нацеливающих» модулей, потенциально применимых для радионуклидной визуализации рецепторов HER2/neu: моноклональные антитела; фрагменты антител (Fab- и Fab2-фрагменты, диабоди, минибоди, одноцепочечные вариабельные фрагменты scFv и нанободи); аптамеры нуклеиновых кислот; рационально сконструированные короткие пептиды и альтернативные каркасные белки (скаффолды), выбранные при помощи молекулярного дисплея (табл. 2) [45, 46].
Таблица 2. Радионуклидная диагностика HER2-позитивного рака молочной железы (клинические исследования)
Тип белка | Название препарата | Способ | Категория пациентов | Ссылка |
Полноразмерные антитела | 111In-трастузумаб | ОФЭКТ/КТ | Метастатический РМЖ | [51–53] |
89Zr-трастузумаб | ПЭТ/КТ | Метастатический РМЖ | [54–56] | |
64Cu-трастузумаб | ПЭТ/КТ | Первичный и метастатический РМЖ | ||
Фрагменты | 68Ga-DOTA-F(ab′)2-трастузумаб | ПЭТ/КТ | Метастатический РМЖ | [59] |
68Ga-HER2-Нанободи | ПЭТ/КТ | Метастатический РМЖ | [60] | |
Альтернативные каркасные | 111In-ABY-002 68Ga-ABY-002 | ОФЭКТ/КТ ПЭТ/КТ | Метастатический РМЖ | [61] |
111In-ABY-025 | ОФЭКТ/КТ | Местно-распространенный | ||
68Ga-ABY-025 | ПЭТ/КТ | Местно-распространенный | [63–65] | |
99mTc-ADAPT6 | ОФЭКТ | Операбельный, местно-распространенный и метастатический РМЖ | [66] | |
99mTc-DARPinG3 | ОФЭКТ | Операбельный, местно-распространенный и метастатический РМЖ | [67] |
Радионуклидная диагностика HER2-позитивного рака молочной железы с использованием полноразмерных антител
Первыми «нацеливающими» модулями для диагностики экспрессии рецептора эпидермального фактора роста типа 2 стали меченные различными радиоизотопами полноразмерные моноклональные антитела [47]. Высокоспецифичное взаимодействие мкАТ с соответствующим антигеном стало отправной точкой для проведения доклинических и клинических исследований, направленных на изучение возможности использования антител в качестве «транспорта» для доставки радионуклидов к опухолевым клеткам, их визуализации или оказания на них радиационного цитотоксического воздействия. Длительная циркуляция мкАТ в организме больного требовала использования долгоживущих позитронных эмиттеров, таких, как 89Zr (цирконий-89), 64Cu (медь-64), 124I (йод-124) и 86Y (иттрий-86) [48].
С момента создания трастузумаба в качестве средства для лечения больных раком молочной железы с гиперэкспрессией HER2/neu меченные различными радиоизотопами молекулы препарата начали активно использовать для изучения диагностической эффективности выявления экспрессии рецептора эпидермального фактора роста типа 2 [49]. Первым меченым моноклональным антителом, прошедшим клиническую апробацию у пациенток с HER2-позитивным раком молочной железы, был препарат «111In-трастузумаб» (111In, период полураспада 2.8 дня) [50]. Сначала изучали преимущественно кардиотоксичность этого соединения. Так, в 2000 году Behr и соавт. наблюдали 20 больных с HER2-положительным метастатическим раком молочной железы, получавших трастузумаб. Они оценивали потенциальный ответ опухоли на терапию, а также возможность прогнозирования кардиотоксичности на фоне проводимого лечения. По результатам этой работы был сделан вывод о возможности использования препарата в качестве предсказательного инструмента в отношении терапевтической эффективности и развития кардиотоксичности на фоне таргетной терапии (табл. 2) [51].
В свою очередь, Perik и соавт. использовали «111In-трастузумаб» у 17 пациенток с метастатическим HER2-позитивным раком молочной железы. Лишь у одной пациентки с тяжелой кардиотоксичностью выявлен слабый захват меченого белка; опухоли, сверхэкспрессирующие эпидермальный фактор роста типа 2, обнаружены в 45% случаев, что свидетельствовало об отсутствии диагностической значимости «111In-трастузумаб» для прогнозирования кардиотоксичности у пациенток данной категории [52].
Sietske и соавт. изучали накопление «111In-трастузумаб» в начале и через 14 недель после терапии герцептином 17 больных HER2-позитивным раком молочной железы. Результаты этого исследования выявили устойчивое поглощение препарата всеми опухолевыми очагами на протяжении всего курса лечения со снижением поглощения всего лишь на 20% к концу терапии. Этот анализ показал, что количество молекул рецептора HER2 на поверхности опухолевой клетки достаточно для связывания с таргетными препаратами; снижение же аккумуляции во многом объяснялось уменьшением объема злокачественных образований на фоне комбинированной химиотаргетной терапии, а также конкуренцией циркулирующего «терапевтического» трастузумаба с мечеными антителами за связывание с целевым рецептором. Полученный результат, по-видимому, можно объяснить недостаточной дозировкой используемого мкАТ и неполной блокировкой рецепторов HER2/neu соответственно [53].
Первое клиническое исследование препарата «89Zr-трастузумаб» (89Zr, период полураспада 78.4 ч), проведенное на 14 больных метастатическим раком молочной железы, показало высокое накопление меченого антитела первичной опухолью и метастатическими узлами с положительным статусом HER2/neu через 4–5 дней после инъекции по данным ПЭТ-исследования (анатомическая локализация которых была сопоставимой с установленной методами компьютерной и магнитно-резонансной томографии). Также были визуализированы метастазы рака молочной железы в головной мозг, обусловленные повреждением гематоэнцефалического барьера в месте метастазирования [54].
Препарат «89Zr-трастузумаб» изучали также Ulaner и соавт. Они провели проспективный клинический анализ 11 больных HER2-негативным раком молочной железы, на момент исследования имевших по крайней мере по одному метастатическому очагу. Через 5–6 дней после введения препарата у 4 из 11 больных (36%) по данным ПЭК/КТ были выявлены метастатические очаги, гиперэкспрессирующие HER2/neu. Однако последующий иммуногистохимический и FISH-анализ опухолевой ткани показал, что для трех из четырех (75%) выявленных узлов результаты оказались ложноположительными. Возможно, столь высокая частота ложноположительных результатов могла быть обусловлена неспецифическим накоплением препарата в опухолевых очагах из-за большого размера его молекул [55].
Gebhart и соавт. в своем мультицентрическом клиническом исследовании (исследование ZEPHIR) оценивали возможность использования ПЭТ с 89Zr-трастузумабом и 18F-фтордезоксиглюкозой (18F-ФДГ) для оценки эффективности терапии трастузумабом эмтанзином (T-DM1) у 56 больных с распространенным HER2-позитивным раком молочной железы. У 16 (29%) больных (ранее по данным ИГХ у них была выявлена высокая экспрессия HER2/neu в метастазах опухоли) не наблюдали накопления 89Zr-трастузумаба, а сочетание 89Zr-трастузумаба и 18F-фтордезоксиглюкозы позволяло в 100% случаев прогнозировать ответ опухоли на проводимое лечение [56].
Свойства и эффективность препарата 64Cu-трастузумаб (период полураспада 64Cu 12.7 ч) изучали Tamura и соавт. и Mortimer и соавт. В первом случае ПЭТ-исследование шести больных c операбельным или метастатическим HER2-позитивным раком молочной железы показало безопасность этого препарата, хорошую визуализацию первичной опухоли и метастазов в головной мозг у двух больных [57]. Эффективность препарата подтверждена в исследовании Mortimer и соавт., проведенном на восьми больных метастатическим HER2-позитивным раком молочной железы. У всех пациенток отмечена хорошая визуализация как первичной опухоли, так и метастатических очагов в костях, лимфатических узлах, печени, легких и плевре [58]. При этом главным недостатком соединений с 64Cu является слишком короткий период полураспада.
Несмотря на положительные результаты, полученные в ходе многочисленных исследований, использование полноразмерных антител в качестве «нацеливающего» модуля выявило и очевидные проблемы, связанные, прежде всего, с размером молекул иммуноглобулинов: медленное выведение мкАТ из организма, существенно снижающее чувствительность визуализации и пролонгирующее начало обследования до 4–7 дней после инъекции; заметно более высокая лучевая нагрузка на пациентов из-за использования долгоживущих источников излучения; медленные экстравазация и диффузия препаратов в интерстицию опухоли и неспецифическое накопление меченых соединений в опухоли (захват опухолью неспецифических антител), приводящее к высокому уровню ложноположительных результатов [68].
Радионуклидная диагностика HER2-позитивного рака молочной железы с применением фрагментов антител
Очевидная необходимость модификации больших размеров антител (150 кДа) и улучшения их фармакокинетики послужили пусковым моментом синтеза фрагментов антител Fab (около 55 кДа) и (Fab)2 (около 110 кДа), полученных путем ферментативной обработки антител пепсином и папаином. Эти фрагменты не обладают эффекторными функциями (что обусловлено отсутствием домена Fc) и не способны к рециркуляции из лизосом. Фрагменты Fab и (Fab)2 специфичны к молекулярным мишеням, как и «родительский» иммуноглобулин, с сохранением пространственной структуры. Оба фрагмента использовали для радионуклидной визуализации злокачественных образований, по результатам которой оценили их преимущества перед полноразмерными антителами, такие, как: более высокая скорость выведения из крови, сокращение времени между инъекцией и визуализацией, снижение поглощенной дозы для пациентов и лучшая контрастность в день инъекции или на следующий день после инъекции, что позволяет использовать относительно короткоживущие радионуклиды, такие, как 99mTc (T1/2 = 6.01 ч) или позитронные излучатели со средним периодом полураспада – 55Co (T1/2 = 17.5 ч), 64Cu (T1/2 = 12.7 ч), 76Br (T1/2 = 16.2 ч) и 86Y (T1/2 = 14.7 ч) [69].
Единственным препаратом данной категории, прошедшим фазу I клинических испытаний, является «68Ga-DOTA-F(ab′)2-трастузумаб», который вводили 16 больным метастатическим или первичным раком молочной железы с различной экспрессией HER2/neu. По данным Beylergil и соавт. соединение хорошо переносилось всеми пациентами без выраженных побочных и аллергических реакций, при этом отмечена его низкая чувствительность (50%): опухоль визуализирована лишь у четырех из восьми HER2-положительных больных и не визуализирована у пациенток с HER2-негативными опухолями [59]. В ходе доклинического и клинического исследования выявлены такие недостатки препаратов данной группы, существенно ограничивающие их использование в клинической практике, как снижение очевидной аффинности связывания по сравнению с моноклональными антителами и все еще существенные размеры для эффективной экстравазации.
Обнаружение верблюжьих антител, состоящих только из тяжелых цепей (HcAbs), спровоцировало разработку антител третьего поколения, состоящих из одного вариабельного домена тяжелой цепи (VHH, ~ 15 кДа) в качестве антигенсвязывающей области и получивших название «нанотела», или «нанободи». Одна из точек приложения нанободи в клинической практике – молекулярная визуализация опухоли, в частности, их использование в ядерной медицине [70, 71]. Так, в фазе I клинического исследования оценили возможность применения препарата «68Ga-HER2-Нанободи» (период полураспада 68Ga 67.7 мин) для выявления экспрессии рецептора HER2 с помощью ПЭТ/КТ у 20 пациенток с первичным или метастатическим раком молочной железы. Показана безопасность препарата и отсутствие побочных реакций при дозе облучения, сопоставимой с дозой других обычно используемых индикаторов ПЭТ, а также его быстрое выведение из кровотока и накопление преимущественно в почках, печени и кишечнике с низкой аккумуляцией в проекции молочной железы и регионарных лимфатических узлах [60]. В настоящий момент продолжается фаза II клинических исследований «68Ga-HER2-Нанободи», в которой определяется экспрессия HER2 в метастазах в головной мозг больных раком молочной железы [72].
Радионуклидная диагностика HER2-положительного рака молочной железы с использованием альтернативных каркасных белков
Поиск новых эффективных агентов, способных взаимодействовать со специфическими мишенями, и стремительное развитие методов генной инженерии положили начало интенсивному изучению и разработке молекулярных конструкций, альтернативных связывающим доменам антител. Эти конструкции должны иметь ряд обязательных характеристик, таких, как связывание исключительно с «таргетным» антигеном для специфической локализации, отсутствие иммуногенности, стабильность, возможность быстрой химической модификации при проведении процессов мечения, а также быстрое удаление несвязавшихся молекул из организма пациента для достижения высокого качества изображения опухолевых очагов и сокращения временного промежутка между инъекцией и началом исследования [73].
В течение последнего десятилетия большую популярность приобретает новый класс таргетных молекул, получивших название «альтернативные каркасные белки» (АКБ), или «скаффолды» (scaffolds), и отвечающих всем требованиям к оптимальной доставке радионуклида к опухолевым клеткам. Впервые термин «скаффолд» ввели Плюктун и соавт. для обозначения белкового каркаса, или остова, в котором путем небольших видоизменений аминокислотных последовательностей становится возможным получать различные варианты белка с разными функциями, среди которых находить варианты, эффективно связывающиеся со специфическими мишенями [74]. К несомненным преимуществам таких конструкций относятся значительно меньшие размеры по сравнению со стандартным антителом, что увеличивает проникновение вещества в опухоль, стабильная структура, дополнительная функционализация и экспрессия в бактериальной системе, обеспечивающие низкие затраты на производство, высокая термостабильность, способствующая длительному хранению препарата при комнатной температуре, а также возможность прямого химического синтеза [75].
Альтернативные каркасные белки можно классифицировать по различным критериям, таким, как размер, способ синтеза, происхождение и биологические функции. Одна из основных систем классификации предполагает разделение каркасных белков в соответствии с элементами структуры, что объясняется возможностью передачи их биологических свойств новым производным. Первый класс составляют соединения доменного строения (domain-sized compounds) (6–20 кДа), такие, как аффибоди (Affibody, Inc.), альбуминсвязывающие домены, имеющие сродство с белком (ADAPTs), аффилины (Scil Proteins GmbH), антикалины (Pierris, Inc.), атримеры (Anaphore, Inc.), дарпины (Dyax, Inc., Shire Inc.), Fn3 скаффолды (Molecular Partners, Inc.), финомерные платформы (Janssen), домены типа ингибитора Кунитца или пронектин (Protelica), последовательности на основе белка FN3 (Protelica, Inc.). Ко второму классу относятся пептиды с закрепленной структурой (constrained peptides) (2–4 кДа), такие, как авимеры (Avimers [Avidia, Inc.]), бициклические пептиды (Bicycle Therapeutics, Inc.) и цистеинсодержащие пептиды. На данный момент клиническую апробацию в диагностике HER2-позитивного рака молочной железы прошли три представителя «скаффолдов»: аффибоди, адапты и дарпины (рис. 1) [76].
Рис. 1. Схематичное изображение ряда альтернативных каркасных белков
Аффибоди. Молекулы аффибоди представляют собой три плотно упакованные альфа-спирали, стабилизированные гидрофобным ядром [77]. Аффибоди – это белки небольшого размера с молекулярной массой 6–7 кДа, состоящие из 58 аминокислотных остатков. Аффибоди имеют высокое сродство к рецепторам HER3, IGF-1R, CAIX и VEGFR2. В ходе доклинических исследований выявлен высокий потенциал аффибоди в качестве «нацеливающих» модулей для радионуклидной диагностики. Наибольшее количество исследований аффибоди проведено на варианте с высокой аффиностью к рецептору HER2/neu [78].
Первым вариантом аффибоди, изученным в клинической практике, стала молекула ABY-002, меченная 111In и 68Ga. В своем исследовании Baum и соавт. выявили отсутствие токсичности препаратов «111In-ABY-002» и «68Ga-ABY-002» у больных раком молочной железы, а также их быстрый клиренс из нормальных тканей. Однако сканирование в режиме «Whole body» через 1, 2 и 4 ч после введения меченых белков обнаружило их высокое накопление в печени и почках [61].
Путем последующего реинжениринга создана модифицированная молекула аффибоди II поколения – ABY-025. В фазе I клинического исследования препарата «111In-ABY-025» на семи больных с местно-распространенным и метастатическим раком молочной железы (пять пациенток со сверхэкспрессией HER2/neu; две – без экспрессии рецептора) Sorensen и соавт. показали безопасность данного соединения и возможность дифференцировки первичной опухоли и метастатических очагов в зависимости от статуса HER2/neu [62]. Однако, несмотря на многообещающие результаты, была обнаружена ограниченная возможность визуализации очагов небольших размеров у HER2-позитивных пациенток при использовании «111In-ABY-025», что, вероятно, обусловлено низким разрешением ОФЭКТ/КТ. Поэтому началось изучение препарата «68Ga-ABY-025» для ПЭТ/КТ. Фаза I клинического исследования показала отсутствие токсического воздействия соединения на организм восьми больных метастатическим раком молочной железы. Кроме того, показана важность дозы препарата, так применение 78 мкг белка приводило к статистически более высокому накоплению препарата в печени и почках по сравнению с аккумуляцией при использовании 427 мкг белка [63]. Последующий анализ 16 больных метастатическим раком молочной железы (12 со сверхэкспрессией HER2/neu; четверо – без) показал не только возможность визуализации метастатических узлов (метастазы в регионарные лимфатические узлы и отдаленные органы и ткани) во всех случаях, но и их точной дифференцировки в зависимости от статуса HER2/neu у больных метастатическим раком молочной железы (рис. 2) [64].
Рис. 2. Пациентка с HER2-негативной первичной опухолью молочной железы. По данным ФДГ-ПЭТ/КТ у больной визуализированы метастазы в левую долю печени, перитонеальные лимфатические узлы и шейку мочевого пузыря. Исследование с «68Ga-ABY-025» выявило высокую аккумуляцию соединения в печеночный метастаз и низкую или отсутствие в остальные очаги. По данным ИГХ статус HER2/neu метастаза в печень – положительный; в остальных очагах – отрицательный
Кроме того, Sandberg и соавт. на 23 пациентках с метастатическим раком молочной железы показали, что в случае препаратов «111In-ABY-025» и «68Ga-ABY-025» селезенка была лучшим референсным органом по всем модальностям (за ней следовали пул крови и легкое). При этом соотношение опухоль/селезенка достигало точности 100% при разделении опухолевых узлов в зависимости от статуса HER2/neu через 4 ч после инъекции, по данным ПЭТ, и 24 ч – ОФЭКТ [65].
Высокая эффективность меченой молекулы аффибоди подтверждена Xu Y. и соавт., которые в предварительном клиническом исследовании препарата «68Ga-NOTA-MAL-Cys-MZHER2:342», выполненном на двух пациентках, показали более высокое накопление соединения в опухоли молочной железы с гиперэкспрессией HER2/neu [79].
ADAPT (ABD-Derived Affinity Proteins). Эти молекулы разработаны с использованием 46-аминокислотного каркаса, полученного из альбуминсвязывающего домена (AСД), который спонтанно складывается в трехспиральную структуру и не зависит от дисульфидных мостиков. Командой Хобер (Королевский технологический институт, Стокгольм, Швеция) создана библиотека, позволяющая синтезировать АСД для различных мишеней, вариантами служили молекулы, нацеленные на различные рецепторы TNFα, HER3 [80]. Тропная к рецептору эпидермального фактора роста HER2/neu молекула ADAPT6 была выбрана из-за ее высокого сродства к HER2/neu (1 нМ) и быстрого выведения из кровотока в связи с низким связыванием с альбумином [81].
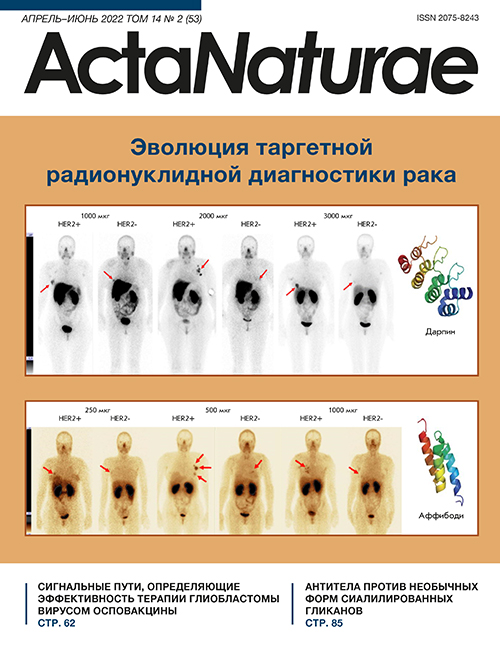
В фазе I клинических исследований препарата «99mTc-ADAPT6» (99mTc, период полураспада 6.01 ч), в которое вошли 22 больных раком молочной железы с различной экспрессией HER2/neu в первичной опухоли. В исследовании использовали три дозировки белка (250, 500 и 1000 мкг). Через 2, 4, 6 и 24 ч после введения меченого белка всем больным выполняли планарную сцинтиграфию в режиме Wholebody и однофотонную компьютерную томографию органов грудной клетки. Результаты исследования показали хорошую переносимость препарата и отсутствие изменений со стороны жизненно важных органов. Лучшее различие в распределении препарата в опухолях с положительным и отрицательным статусами HER2/neu наблюдали через 2 ч после инъекции соединения в дозе 500 мкг (среднее значение опухоль/фон 37 ± 19 для HER2-позитивных опухолей и с 5 ± 2 для HER2-негативных, p < 0.05, тест Манна–Уитни). Различие между группами на других временных отрезках не было статистически значимым. Соотношение опухоль/фон в HER2-положительных опухолях было значительно выше у пациенток, получивших дозу 500 мкг по сравнению с 250 и 1000 мкг (p <0.05, тест Манна–Уитни). Кроме того, определена относительно низкая дозовая нагрузка на пациента при использовании 500 и 1000 мкг белка – 0.009 ± 0.002 и 0.010 ± 0.003 мЗв/МБк соответственно, что сопоставимо с данными, полученными при изучении других представителей АКБ (рис. 3) [66, 82].
Рис. 3. Передняя проекция планарной сцинтиграфии больных раком молочной железы, экспрессирующих и не экспрессирующих HER2/neu (HER2+ и HER2-) через 2 ч после инъекции 250, 500 и 1000 мкг препарата «99mTc-ADAPT6» (стрелками указана опухоль молочной железы)
Дарпины (DARPins – Designed Ankyrin Repeat Proteins) – представители АКБ, сконструированные на основе белков анкиринов. Анкирины участвуют в прикреплении мембранных белков к цитоскелету [83]. Каркас дарпинов может включать 4–6 анкириновых доменов, каждый из которых содержит 33 аминокислотных остатка; домены организованы как две антипараллельные альфа-спирали с бета-поворотом между ними [84]. Поскольку молекулярная масса одного модуля чуть больше 3.5 кДа, а дарпины состоят из 4–6 модулей, их молекулярная масса колеблется от 14 до 21 кДа и составляет примерно одну десятую размера обычного антитела (IgG) или одну треть размера Fab [85]. Доклинические исследования различных вариаций дарпинов показали их высокую тропность и специфичность к рецептору HER2/neu [86, 87].
Проведена фаза I клинических исследований препарата «99mTc-DARPinG3» в дозе: 1000, 2000 и 3000 мкг, в которое вошли 28 больных раком молочной железы с различной экспрессией HER2/neu. Пациенткам выполняли планарную сцинтиграфию в режиме Wholebody и однофотонную компьютерную томографию органов грудной клетки через 2, 4, 6 и 24 ч после введения препарата. Показано отсутствие токсического воздействия препарата в использованных дозах «99mTc-DARPinG3» на организм за весь период наблюдения, быстрое его выведение с током крови, а также относительно низкая дозовая нагрузка на пациента (0.011 ± 0.001, 0.012 ± 0.006 и 0.012 ± 0.003 мЗв/МБк соответственно) (рис. 4). Лучшее соотношение опухоль/фон отмечено у больных со сверхэкспрессией HER2/neu в опухоли через 2 и 4 ч после инъекции 1000 и 2000 мкг меченого белка; и через 2, 4 и 6 ч в подгруппе, получившей 3000 мкг (p < 0.05, тест Манна–Уитни). При этом наиболее эффективной дозой, позволяющей визуализировать метастазы в печени, оказалась доза 3000 мкг [67].
Рис. 4. Передняя проекция планарной сцинтиграфии больных раком молочной железы, экспрессирующих (HER2+) и не экспрессирующих (HER2-) HER2/neu через 4 ч после инъекции 1000, 2000 и 3000 мкг препарата «99mTc-DARPinG3» (стрелками указана опухоль молочной железы)
ЗАКЛЮЧЕНИЕ
Диагностика HER2-позитивного рака молочной железы остается одной из не до конца решенных проблем клинической онкологии. Ни один из существующих методов диагностики на позволяет полностью решить поставленные задачи и, как правило, требует проведения дополнительных дорогостоящих, инвазивных и порой влекущих за собой различные осложнения манипуляций [26, 28]. Эта проблема становится особенно очевидной при решении вопроса о молекулярных характеристиках выявленных опухолевых узлов (метастазов) и выборе оптимального объема системного лечения.
В настоящее время стремительно развиваются методы таргетной радионуклидной визуализации, которые расширяют возможности диагностики злокачественных образований [88]. Информация, представленная в данном обзоре, позволяет более детально взглянуть на эволюцию радионуклидной диагностики HER2-позитивного рака молочной железы с использованием в качестве «нацеливающего» модуля различных структур – от «полноразмерных» антител до новой группы синтетических белков небольшого размера – альтернативных каркасных белков, представленных разнообразными молекулярными формами с различными структурами, зарядами и липофильностью аминокислотных остатков, подверженных воздействию растворителя. Многочисленные доклинические исследования меченых белков определили оптимальные характеристики скаффолдов для молекулярной визуализации, а также их высокую специфичность к таргетной мишени.
Проведенные к настоящему времени клинические исследования соединений на основе таких белков, как аффибоди, адапты и дарпины для ОФЭКТ и ПЭТ, показали их хорошую переносимость, быстрое выведение из организма и возможность дифференцировки опухолевых очагов в зависимости от статуса рецептора эпидермального фактора роста HER2/neu. Неоспоримым преимуществом методов данного типа перед стандартными диагностическими подходами (FISH и ИГХ) является возможность одномоментного выявления дополнительных опухолевых узлов и определения их молекулярного фенотипа. Убедительные результаты, полученные в ходе первых клинических испытаний, свидетельствуют о перспективности таргетной радионуклидной диагностики и необходимости продолжения исследований в данном направлении.
Работа выполнена в рамках гранта Министерства науки и высшего образования, соглашение № 075-15-2022-1103 по теме «Разработка таргетных молекул на основе каркасных белков для диагностики и терапии злокачественных новообразований: тераностический подход».
Об авторах
Ольга Дмитриевна Брагина
Томский национальный исследовательский медицинский центр РАН; Национальный исследовательский Томский политехнический университет
Email: rungis@mail.ru
Россия, 634009, Томск; 634050, Томск
Сергей Михайлович Деев
Национальный исследовательский Томский политехнический университет; Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Email: rungis@mail.ru
Россия, 634050, Томск; 117997, Москва
Владимир Иванович Чернов
Томский национальный исследовательский медицинский центр РАН; Национальный исследовательский Томский политехнический университет
Email: rungis@mail.ru
Россия, 634009, Томск; 634050, Томск
Владимир Максимиллианович Толмачев
Национальный исследовательский Томский политехнический университет; Упсальский университет
Автор, ответственный за переписку.
Email: rungis@mail.ru
Россия, 634050, Томск; Упсала, Швеция
Список литературы
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, 2020. 251 с.
- Lambertini M., Viglietti G. // Oncotarget. 2019. V. 10. № 8. P. 803–804. doi: 10.18632/oncotarget.26611
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. // CA Cancer J. Clin. 2018. V. 68. № 6. P. 394–424. doi: 10.3322/caac.21492
- Cardoso F., Kyriakides S., Ohno S., Penault-Llorca F., Poortmans P., Rubio I.T., Zackrisson S., Senkus E. // Ann. Oncol. 2019. V. 30. № 8. P. 1194–1220. doi: 10.1093/annonc/mdz173
- Carioli G., Malvezzi M., Rodriguez T., Bertuccio P., Negri E., Vecchia C. // Breast. 2017. V. 36. P. 89–95. doi: 10.1016/j.breast.2017.06.003
- Sachdev J.C., Sandoval A.C., Jahanzeb M. // Cancer Treat. Res. 2019. V. 178. P. 45–80. doi: 10.1007/978-3-030-16391-4_2
- Arranja A.G., Pathak V., Lammers T., Shi Y. // Pharmacol. Res. 2017. V. 115. P. 87–95. doi: 10.1016/j.phrs.2016.11.014
- Navalkissoor S., Gnanasegaran G., Baum R. // Br. J. Radiol. 2018. V. 91. № 1091. P. 20189004. doi: 10.1259/bjr.20189004
- Turner J.H. // Br. J. Radiol. 2018. V. 91. № 1091. P. 20180440. doi: 10.1259/bjr.20180440
- Langbein T., Weber W.A., Eiber M. // J. Nucl. Med. 2019. V. 60. № 9 (Suppl. 2). P. 13S–19S. doi: 10.2967/jnumed.118.220566
- Lymperopoulos G., Lymperopoulos P., Alikari V., Dafogianni C., Zyga S., Margari N. // Adv. Exp. Med. Biol. 2017. V. 989. P. 119–128. doi: 10.1007/978-3-319-57348-9_10
- Wiesing U. // Med. Hlth Care Philos. 2019. V. 22. № 4. P. 593–597. doi: 10.1007/s11019-019-09898-3.
- Duffy M.J., Harbeck N., Nap M., Molina R., Nicolini A., Senkus E., Cardoso F. // Eur. J. Cancer. 2017. V. 75. P. 284–298. doi: 10.1016/j.ejca.2017.01.017
- Nagini S. // Anticancer Agents Med. Chem. 2017. V. 17. P. 152–163. doi: 10.2174/1871520616666160502122724
- Broughton M.N., Westgaard A., Paus E., Øijordsbakken M., Henanger K.J., Naume B., Bjoro T. // Tumour Biol. 2017. V. 39. № 6. P. 1010428317707436. doi: 10.1177/1010428317707436
- Han L., Li L., Wang N., Xiong Y., Li Y., Gu Y. // Interferon Cytokine Res. 2018. V. 38. № 12. P. 578–582. doi: 10.1089/jir.2018.0085
- Ahn S., Woo J.W., Lee K., Park S.Y. // J. Pathol. Transl. Med. 2020. V. 54. № 1. P. 34–44. doi: 10.4132/jptm.2019.11.03
- Schwill M., Tamaskovic R., Gajadhar A.S., Kast F., White F.M., Pluckthun A. // Sci. Signal. 2019. V. 12. № 565. P. eaau2875. doi: 10.1126/scisignal.aau2875
- Pareek A., Singh O.P., Yogi V., Ghori H.U., Tiwari V., Redhu P. // Cancer Res. Ther. 2019. V. 15. № 5. P. 971–975. doi: 10.4103/jcrt.JCRT_235_18
- Waks A.G., Winer E.P. // J. Am. Med. Assoc. 2019. V. 321. № 3. P. 288–300. doi: 10.1001/jama.2018.19323
- Slamon D.J., Clark G.M., Wong S.G., Levin W.J., Ullrich A., McGuire W.L. // Science. 1987. V. 235. № 4785. P. 177–182. doi: 10.1126/science.3798106
- Marshall D.A., Ferrusi I.L., Trudeau M., Leighl N.B., Hoch J.S., Grazziotin L.R., Khong H., Pullenayegum E., Earle G.C. // J. Oncol. Pharm. Pract. 2020. V. 26. № 2. P. 379–385. doi: 10.1177/1078155219850299
- Pernas S., Tolaney S.M. // Ther. Adv. Med. Oncol. 2019. V. 11. P. 1758835919833519. doi: 10.1177/1758835919833519
- Tsai Y.F., Tseng L.M., Lien P.J., Hsu C., Lin Y., King K., Wang Y., Chao T., Liu C., Chiu J., et al. // Histopathology. 2019. V. 74. № 4. P. 578–586. doi: 10.1111/his.13801
- Stewart R.L., Caron J.E., Gulbahce E.H., Factor R.E., Geiersbach K.B., Downs-Kelly E. // Mod. Pathol. 2017. V. 30. № 11. P. 1561–1566. doi: 10.1038/modpathol.2017.65
- Agersborg S., Mixon C., Nguyen T., Aithal S., Sudarsanam S., Blocker F., Weiss L., Gasparini R., Jiang S., Chen W., et al. // Breast Cancer Res. Treat. 2018. V. 170. № 2. P. 321–328. doi: 10.1007/s10549-018-4755-5
- Bo W., Ding W., Sun K., Wang X., Xu L., Teng X.// Sci. Rept. 2019. V. 9. P. 16726. doi: 10.1038/s41598-019-53003-w
- Furerr D., Jacobs S., Caron C., Sanschagrin F., Provencher L., Diorio C. // Anticancer Res. 2017. V. 37. P. 3323–3329. doi: 10.21873/anticanres.11701
- Schrijver W., Suijkerbuijk K.P.M., van Gils C.H., van der Wall E., Moelans C.B., van Diest P.J. // J. Natl. Cancer Inst. 2018. V. 110. № 6. P. 568–580. doi: 10.1093/jnci/djx273
- Kroigard A.B., Larsen M.J., Thomassen M., Kruze T.A. // Breast J. 2016. V. 22. № 4. P. 420–430. doi: 10.1111/tbj.12596
- Raica M., Cimpean A.M., Ceasu R.A., Fulga V., Nica C., Rudico L., Sapefrati L. // Anticancer Res. 2014. V. 34. P. 1435–1440.
- Lower E.E., Khan S., Kennedy D., Baughman R.P. // Breast Cancer – Targets and Therapy. 2017. V. 9. P. 515–520. doi: 10.2147/BCTT.S137709
- Turner N.H., Di Leo A. // Cancer Treat. Rev. 2013. V. 39. № 8. P. 947–957. doi: 10.1016/j.ctrv.2013.05.003
- Griguolo G., Pascual T., Dieci M.V., Guarneri V., Prat A. // J. Immunother. Cancer. 2019. V. 7. № 1. P. 90. doi: 0.1186/s40425-019-0548-6
- Ocaña A., Amir E., Pandiella A. // Breast Cancer Res. 2020. V. 22. № 1. P. 15. doi: 10.1186/s13058-020-1252-7
- Muller K., Marotti J., Tafe L. // Am. J. Clin. Pathol. 2019. V. 152. № 1. P. 10. doi: 10.1093/ajcp/aqz010
- Pekar G., Kasselaki I., Pekar-Lukacs A., Dekany C., Hellberg D., Tot T. // Histopathology. 2019. V. 74. № 2. P. 300–310. doi: 10.1111/his.13733
- Jadvar H., Chen X., Cai W., Mahmood U. // Radiology. 2018. V. 286. № 1. P. 388–400. doi: 10.1148/radiol.2017170346
- Stéen E.J.L., Edem P.E., Nørregaard K., Jorgensen J.T., Shalgunov V., Kjaer A., Herth M.M. // Biomaterials. 2018. V. 179. P. 209–245. doi: 10.1016/j.biomaterials.2018.06.021
- Li L., Wu Y., Wang Z., Jia B., Hu Z., Dong C., Wang F. // J. Nucl. Med. 2017. V. 58. P. 821–826. doi: 10.2967/jnumed.116.183863
- Ljungberg M., Pretorius P.H. // Br. J. Radiol. 2018. V. 91. № 1081. P. 20160402. doi: 10.1259/bjr.20160402
- Massicano A.V.F., Marquez-Nostra B.V., Lapi S.E. // Mol. Imaging. 2018. V. 17. P. 1–11.
- Gallivanone F., Valente M., Savi A., Canevari C., Castiglioni I. // Front. Biosci. (Landmark Ed). 2017. V. 22. P. 1750–1759. doi: 10.2741/4569
- Pandit-Taskar N.J. // Med. Imaging Radiat. Sci. 2019. V. 50. № 4 (Suppl. 1). P. 41–44. https://doi.org/10.1016/j.jmir.2019.07.006
- Tolmachev V., Orlova A., Sorensen J. // Semin Cancer Biol. 2021. V. 72. P. 185–197. doi: 10.1016/j.semcancer.2020.10.005
- Garousi J., Orlova A., Freid F.Y., Tolmachev V. // EJNMMI Radiopharmacy Chem. 2020. V. 5. P. 16. doi: 10.1186/s41181-020-00094-w
- Hanack K., Messerschmidt K., Listek M. // Adv. Exp. Med. Biol. 2016. V. 917. P. 11–22. doi: 10.1007/978-3-319-32805-8_2
- Ovacik M., Lin K. // Clin. Transl. Sci. 2018. V. 11. № 6. P. 540–552. doi: 10.1111/cts.12567
- Mueller C., Haymond A., Davis J.B., Williams A., Espina V. // Expert Rev. Proteomics. 2018. V. 15. № 2. P. 131–152. doi: 10.1080/14789450.2018.1421071
- Gebhart G., Flamen P., DeVries E.G.E., Jhaveri K., Wimana Z. // J. Nucl. Med. 2016. V. 57. № 2 (Suppl. 1). P. 81S–88S. doi: 10.2967/jnumed.115.157941
- Behr T.M., Behe M., Wormann B. // N. Engl. J. Med. 2001. V. 345. № 13. P. 995–996. doi: 10.1056/NEJM200109273451312
- Perik P.J., Hooge M.L., Gietema J.A., Graaf W.T., Korte M.A., Jonkman S., Kosterink J.G., Veldhuisen D.J., Sleifer D.T., et al. // J. Clin. Oncol. 2006. V. 20. № 15. P. 2276–2282.
- Sietske B.M., de Jong J., Perik P.J., Brouwers H., Schroder C.P., Munnink T., Bongaerts A.H.H., de Vries E.G.E., Hooge M.N. // Mol. Imaging. 2014. V. 13. P. 1–6. doi: 10.2310/7290.2014.00011
- Dijekers E.C., Munnik T.H., Kosterink J.G., Brouwers A.H., Jager P.L., Jong J.R., Dongen G.A., Schroder C.P., Hooge M.N., Vries E.G. // Clin. Pharmacol. Ther. 2010. V. 87. № 5. P. 586–592. doi: 10.1038/clpt.2010.12
- Ulaner G.A., Hyman D.M., Lyashchenko S.K., Lewis J.S., Carrasquillo J.A. // Clin. Nucl. Med. 2017. V. 42. P. 912–917. doi: 10.1097/RLU.0000000000001820
- Gebhart G., Lamberts L.E., Wimana Z., Garcia C., Emonts P., Ameye L., Stroobants S., Huizing M., Aftimos P., Tol J., et al. // Ann. Oncol. 2016. V. 27. № 4. P. 619–624. doi: 10.1093/annonc/mdv577
- Tamura K., Kurihara H., Yonemori K., Tsuda H., Suzuki J., Kona Y., Honda N., Kodaira M., Yamamoto H., Yunokawa M., et al. // J. Nucl. Med. 2013. V. 54. № 11. P. 1869–1875. doi: 10.2967/jnumed.112.118612
- Mortimer J.E., Balding J.R., Colcher D.M., Conti P.S., Frankel P.H., Carrol M.I., Tong S., Poku E., Miles J.K., Shively J.E., et al. // J. Nucl. Med. 2014. V. 55. № 1. P. 23–29. doi: 10.2967/jnumed.113.122630
- Beylergil V., Morris P.G., Smith-Jones P.M., Modi S., Solit D., Hudis C.A., Lu Y., O`Donoghue J., Lyashchenko S.K., Carrasquillo J.A., et al. // Nucl. Med. Commun. 2013. V. 34. № 12. P. 1157–1165. doi: 10.1097/MNM.0b013e328365d99b
- Keyaerts M., Xavier C., Heemskerk J., Devoogdt N., Evaraert H., Ackaert C., Vanhoeij M., Duhoux F.P., Gevaert T., Simon P., et al. // J. Nucl. Med. 2016. V. 57. № 1. P. 27–33. doi: 10.2967/jnumed.115.162024
- Baum R.P., Prasad V., Muller D., Schuchardt C., Orlova A., Wennborg A., Tolmachev V., Feldwisch J. // J. Nucl. Med. 2010. V. 51. № 6. P. 892–897. doi: 10.2967/jnumed.109.073239.
- Sorensen J., Sandberg D., Sandstrom M., Wennborg A., Feldwisch J., Tolmachev V., Astrom G., Lubberink M., Garske-Roman U., Carlsson J., Lindman H. // J. Nucl. Med. 2014. V. 55. № 5. P. 730–735. doi: 10.2967/jnumed.113.131243
- Sandström M., Lindskog K., Velikyan I., Wennborg A., Feldwisch J., Sandberg D., Tolmachev V., Orlova A., Sorensen J., Carlson J., et al. // J. Nucl. Med. 2016. V. 57. № 6. P. 86–71. doi: 10.2967/jnumed.115.169342
- Sorensen J., Velikyan I., Sandberg D., Wennborg A., Feldwisch., Tolmachev V., Orlova A., Sandstrom M., Lubberink M., Olofsson H., Carlsson J., et al. // Theranostics. 2016. V. 6. № 2. P. 262–271. doi: 10.7150/thno.13502
- Sandberg D., Tolmachev V., Velikyan I., Olofsson H., Wennborg A., Feldwisch J., Carlsson J., Lindman H., Sorensen J. // Eur. J. Nucl. Med. Mol. Imaging. 2017. V. 44. P. 1337–1346. doi: 10.1007/s00259-017-3650-3
- Bragina O., von Witting E., Garousi J., Zelchan R., Sandstrom M., Orlova A., Medvedeva A., Doroshenko A., Vorobyeva A., Lindbo S., et al. // J. Nucl. Med. 2021. V. 62. № 4. P. 493–499. doi: 10.2967/jnumed.120.248799
- Bragina O., Chernov V., Schulga A., Konovalova E., Garbukov E., Vorobyeva A., Orlova A., Tashireva L., Sorensen J., Zelchan R., et al. // J. Nucl. Med. 2021. V. 63. № 4. P. 528–535. doi: jnumed.121.262542. doi: 10.2967/jnumed.121.262542
- Sivelle C., Sierocki R., Ferreira-Pinto K., Simon S., Maillere B., Nozach H. // MAbs. 2018. V. 10. № 5. P. 720–729. doi: 10.1080/19420862.2018
- Gebauer M., Skerra A. // Curr. Opin. Biotechnol. 2019. V. 60. P. 230–241. doi: 10.1016/j.copbio.2019.05.007
- Yang E.Y., Shan K. // Front. Oncol. 2020. V. 10. P. 1182. doi: 10.3389/fonc.2020.01182
- Kijanka M., Dorresteijin B., Oliveira S., van Bergen P.M.P. // Nanomedicine. 2015. V. 10. № 1. P. 161–174. doi: 10.2217/nnm.14.178
- Keyaerts M., Xavier C., Everaet H., Vaneycken I., Fontaine C., Decoster L., Vanhoeij M., Cavelier V., Lahoutte T. // Ann. Oncol. 2019. V. 30. Suppl. 3. P. III25–III26. doi: 10.1093/annonc/mdz095.081
- Шипунова В.О., Деев С.М. // Acta Naturae. 2022. T. 14. № 1(52). C. 54–72. doi: 10.32607/actanaturae.11545
- Martin H.L., Bedford R., Heseltine S.J., Tang A.A., Haza K.Z., Rao A., Mcpherson M.J., Tomlinson D.C. // Biotechnol. 2018. V. 45. P. 28–35. https://doi.org/10.1016/j.nbt.2018.02.008
- Krasniqi A., D’Huyvetter M., Devoogdt N., Frejd F.Y., Sorensen J., Orlova A., Keyaerts M., Tolmachev V. // J. Nucl. Med. 2018. V. 59. P. 885–891. doi: 10.2967/jnumed.117.199901
- Брагина О.Д., Чернов В.И., Зельчан Р.В., Синилкин И.Г., Медведева А.А., Ларькина М.С. // Бюл. сиб. мед. 2019. Т. 18. № 3. С. 125–133. https://doi.org/10.20538/1682-0363-2019-3-125-133
- Tolmachev V., Tran T.A., Rosik D., Sjoberg A., Abrahmsen L. Orlova A. // J. Nucl. Med. 2012. V. 53. P. 953–960. doi: 10.2967/jnumed.111.101527
- Tolmachev V., Gronroos T.J., Yim C.B., Garosi J., Yue Y., Grimm S., Rajander J., Perols A., Haaparanta-Solin M., Solin O., Ferdani R., Orlova A., Anderson C.J., Karlstrom A.E. // Sci. Rep. 2018. V. 8. P. 6542. doi: 10.1038/s41598-018-24785-2
- Xu Y., Wang L., Pan D., Yu C., Mi B., Huang Q., Sheng J., Yan J., Wang X., Yang R., Yang M. // Br. J. Radiol. 2019. V. 92. № 1104. P. 20190425. doi: 10.1259/bjr.20190425
- Garousi J., Lindbo S., Borin J., von Witting E., Vorobyeva A., Oroujeni M., Mitran B., Orlova A., Buijs J., Tolmachev V., et al. // Eur. J. Pharm. Biopharm. 2019. V. 134. P. 37–48. doi: 10.1016/j.ejpb.2018.11.004
- von Witting E., Garousi J., Lindbo S., Vorobyeva A., Altai M., Oroujeni M., Mitran B., Orlova A., Hober S., Tolmachev V. // Eur. J. Pharm. Biopharm. 2019. V. 140. P. 109–120. doi: 10.1016/j.ejpb.2019.05.008
- Брагина О.Д., Чернов В.И., Гарбуков Е.Ю., Дорошенко А.В., Воробьева А.Г., Орлова А.М., Толмачев В.М. // Бюл. сиб. мед. 2021. Т. 20. № 1. С. 23–30. https://doi.org/10.20538/1682-0363-2021-1-23-30
- Plückthun A. // Annu Rev. Pharmacol. Toxicol. 2015. V. 55. P. 489–511. doi: 10.1146/annurev-pharmtox-010611-134654
- Stumpp M.T., Dawson K.M., Binz H.K. // BioDrugs. 2020. V. 34. № 4. P. 423–433. doi: 10.1007/s40259-020-00429-8
- Shilova O.N., Deyev S.M. // Acta Naturae. 2019. V. 11. № 4. P. 42–53. doi: 10.32607/20758251-2019-11-4-42-53
- Vorobyeva A., Garousi J., Tolmachev V., Shulga A., Konavalova E., Deyev S., Gulr R., Lofblom J., Sandstrom M., Chernov V., et al. // Sci. Rept. 2019. V. 9. № 1. P. 9405. doi: 10.1038/s41598-019-45795-8
- Vorobyeva A., Bragina O., Altai M., Mitran B., Orlova A., Shulga A., Proshkina G., Chernov V., Tolmachev V., Deyev S. // Contrast Media Mol. Imaging. 2018. V. 2018. P. 6930425. doi: 10.1155/2018/6930425
- Tolmachev V.M., Chernov V.I., Deyev S.M. // Rus. Chem. Rev. 2022. V. 91. RCR5034. https://doi.org/10.1070/RCR5034
Дополнительные файлы