Распознающие cкаффолдовые полипептиды как инструмент для адресной доставки наноструктур in vitro и in vivo
- Авторы: Шипунова В.О.1, Деев С.М.1
-
Учреждения:
- Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
- Выпуск: Том 14, № 1 (2022)
- Страницы: 54-72
- Раздел: Обзоры
- Дата подачи: 04.08.2021
- Дата принятия к публикации: 11.02.2022
- Дата публикации: 10.05.2022
- URL: https://actanaturae.ru/2075-8251/article/view/11545
- DOI: https://doi.org/10.32607/actanaturae.11545
- ID: 11545
Цитировать
Аннотация
Традиционные средства адресной доставки наноструктур, такие, как антитела, трансферрин, лектины или аптамеры, зачастую могут вызывать целый спектр нежелательных эффектов. При этом большой размер антител часто не позволяет разместить необходимое количество молекул на поверхности наноструктур, а константные домены тяжелых цепей, благодаря их эффекторным функциям, могут вызывать фагоцитоз. В последние два десятилетия гораздо более эффективными инструментами для направленной доставки считаются миметики антител – адресные полипептидные скаффолдовые (каркасные) молекулы неиммуноглобулиновой природы. Они обладают малым размером (3–20 кДа), высокой аффинностью (от субнано- до фемтомолярных значений констант связывания), низкой иммуногенностью, исключительной термодинамической стабильностью. Эти молекулы эффективно нарабатывают в бактериальных продуцентах и с помощью генно-инженерных манипуляций создают мультиспецифичные белки слияния для нацеливания наночастиц на клетки с заданным молекулярным профилем, что делает скаффолдовые полипептиды оптимальным средством для тераностики.
Ключевые слова
Полный текст
СПИСОК СОКРАЩЕНИЙ ЛППР – локализованный поверхностный плазмонный резонанс; МРТ – магнитно-резонансная томография; МЧ – магнитные наночастицы; ПМАО – чередующийся сополимер малеинового ангидрида с 1-октадеценом; ПЭГ – полиэтиленгликоль; ПЭТ – позитронно-эмиссионная томография; ADAPT – каркасный белок на основе домена, связывающего альбумин; Bs-C-Mms6 – барстар, слитый с C-Mms6; DARP – дарпин (designed ankyrin repeat protein); DARP 9_29-Bn – дарпин 9_29, слитый с барназой; DARP-LoPE –дарпин 9_29, слитый с LoPE; DOTA – додекантетрауксусная кислота; EDC – 1-этил-3-(3-диметиламинопропил)карбодиимид; eEF2 – эукариотический фактор элонгации 2; IGF-1R – рецептор инсулиноподобного фактора роста 1; EpCAM – рецептор, молекула клеточной адгезии эпителия; EPR – эффект повышенной проницаемости и удержания; HER2 – рецептор эпидермального фактора роста 2 человека; IgE – иммуноглобулин E; IgG – иммуноглобулин G; NHS – гидроксисукцинимид; PE, ETA – экзотоксин А синегнойной палочки Pseudomonas aeruginosa; PRINT – технология репликации в несмачиваемых молдах (particle replication in nonwetting templates); ScFv – одноцепочечный фрагмент легкой и тяжелой цепи иммуноглобулина; SBP – пептид, связывающий SiO2-поверхность; SPIO – суперпарамагнитные наночастицы; TNF-α – фактор некроза опухоли; VEGF-A – фактор роста сосудистого эндотелия.
1. ВВЕДЕНИЕ
Разработка новых и совершенствование уже существующих методов высокочувствительной диагностики и адресной терапии онкологических заболеваний – одно из основных направлений современной нанобиомедицины. При этом ключевую проблему тераностики относительно нового подхода к созданию препаратов, которые одновременно являются средствами ранней диагностики, терапевтическими агентами и инструментами мониторинга эффективности проводимой терапии, представляет адресная доставка препаратов [1, 2].
Перспективными объектами для создания агентов для тераностики являются наночастицы различной природы (рис. 1). Наночастицы обладают самым широким спектром уникальных характеристик: имеют малый размер, высокое соотношение площади поверхности к количеству объемных атомов, способность образовывать комплексы «наночастица–лиганд», в том числе с большими (относительно собственного размера) соединениями (такими, как белки, различные лекарственные препараты и др.), и селективно доставлять их к заданной цели, реализуя тем самым стратегию адресной доставки. Эти и многие другие преимущества позволяют использовать наночастицы в качестве диагностических и терапевтических агентов в различных областях медицины, в частности, для обнаружения и оптической визуализации злокачественных новообразований и адресной доставки лекарственных препаратов. Однако успешное внедрение нанобиокомплексов в клиническую практику ограничено рядом причин. Так, в частности, необходимо иметь конструкции, обладающие минимальной токсичностью, высокой специфичностью распознавания мишени, максимальной терапевтической и нацеливающей эффективностью. При этом такие комплексы должны обладать низкой иммуногенностью, чтобы обеспечить возможность проведения нескольких курсов терапии.
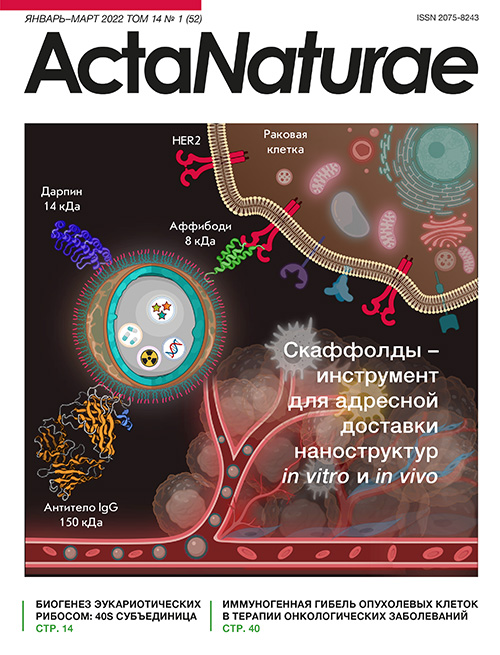
Рис. 1. Наночастицы как платформа для создания средств тераностики. На схеме представлена наночастица «ядро–оболочка», служащая матрицей для загрузки как диагностических (флуоресцентных или радиоактивных), так и терапевтических соединений (химиотерапевтические вещества, гены). Поверхность наночастицы модифицируют различными направляющими соединениями: традиционно с этой целью применяют антитела (IgG, 150 кДа) либо скаффолдовые полипептиды – дарпины (14 кДа) или аффибоди (8 кДа). Представлены наноструктуры, нацеленные на онкомаркер HER2, сверхэкспрессирующийся на поверхности клеток рака молочной железы человека. Рисунок создан в Biorender.com
В терапии опухолей уже применяется более 20 препаратов на основе наночастиц, а ряд соединений проходит завершающие фазы клинических испытаний. Эффективность этих препаратов, например, липосомной формы доксорубицина (липосомы – Миоцет или липосомы, покрытые ПЭГ – Келикс) или мицеллярной формы паклитаксела (Генексол-РМ), основана на эффекте повышенной проницаемости и удержания сосудов опухоли (EPR-эффект, enhanced permeability and retention effect). В связи с высокой потребностью в кислороде и питании в опухоли возникает новая сосудистая сеть, сформированная дефектными эндотелиальными клетками с широкими фенестрациями (до 4 мкм), при этом сосуды не имеют гладкомышечного слоя и эндотелиальные клетки обладают недостатком рецепторов ангиотензина II. Нарушение лимфооттока, наблюдаемое в агрегатах опухолевых клеток размером 150–200 мкм, окруженных такой сосудистой сетью, позволяет молекулам и наноструктурам размером до 150 нм задерживаться в области опухоли и оказывать терапевтическое воздействие.
Однако EPR-эффект характеризуется значительной гетерогенностью (как между разными опухолевыми моделями, так и в пределах даже одной опухоли) и гораздо более выражен у грызунов с ксенографтными опухолями по сравнению с опухолями у людей. Это связано с более низкой скоростью роста опухоли у человека и формированием нормальной сосудистой сети с развитым лимфооттоком по сравнению с быстропролиферирующими опухолями у грызунов [3, 4]. При этом, даже в случае действительно сильного EPR-эффекта (например, при быстро развивающейся саркоме Капоши), в опухоль попадает лишь незначительное число введенных наночастиц (менее 0.7%) [5]. На сегодняшний день нерешенными остаются следующие проблемы нанобиомедицины: терапия агрессивных метастазирующих опухолей [6], интеграция методов персонализированной неинвазивной диагностики и терапии [7], создание физиологически релевантных животных моделей с ксенотрансплантатами [4].
Существуют различные подходы к направленной доставке соединений в область опухоли, в основном, предполагающие повышение эффективности связывания с раковыми клетками, клетками эндотелия или клетками иммунной системы [8], интернализацию соединений в клетку и их контролируемое высвобождение (в том числе под воздействием внешних факторов – света, pH, температур, электромагнитных полей и др.) [9–13]. Поверхность наноструктур модифицируют направляющими агентами различной природы, например, антителами и их производными [14, 15], трансферрином, эпидермальным фактором роста, лектинами [16], молекулами на основе ДНК/РНК (аптамеры, белково-нуклеиновые кислоты), низкомолекулярными веществами (фолиевая кислота, сахара – например, галактозамин) и другими соединениями.
Использование этих молекул приводит к целому спектру нежелательных эффектов. Так, большой размер антител IgG часто не позволяет эффективно использовать поверхность наноструктур при их модификации; константные домены тяжелых цепей обладают эффекторными функциями, которые могут вызывать фагоцитоз, приводя к воспалительным процессам, не участвуя при этом в селективном распознавании мишени, или к нежелательной иммуномодуляции in vivo. Размер антител ограничивает диффузию молекул в глубину опухоли.
Более эффективными инструментами нацеливания наноструктур на клетки-мишени представляются адресные полипептидные каркасные молекулы неиммуноглобулиновой природы, которые получают технологиями фагового, клеточного или рибосомного дисплея. Данные полипептиды получают путем мутагенеза белковых мотивов, участвующих в белок-белковых взаимодействиях в живых системах. К наиболее ярким представителям данной группы нацеливающих соединений относятся аффибоди и дарпины (рис. 1).
2. ОСНОВНЫЕ СТРУКТУРНЫЕ ХАРАКТЕРИСТИКИ СКАФФОЛДОВЫХ БЕЛКОВ И ИХ ПРЕИМУЩЕСТВА ПЕРЕД ПОЛНОРАЗМЕРНЫМИ АНТИТЕЛАМИ
Гибридомная технология получения моноклональных антител, описанная Георгом Кёлером и Сезаром Мильштейном и удостоенная Нобелевской премии по физиологии и медицине за 1984 год, позволила значительно преуспеть в реализации концепции «магической пули». Эта концепция, сформулированная Паулем Эрлихом, заключается в создании эффективного способа доставки терапевтического средства только к очагу болезни без воздействия на здоровые ткани и без развития нежелательных побочных эффектов. На сегодняшний день более восьми десятков антител уже прошли клинические испытания и одобрены для использования в клинике. Однако даже эти антитела вызывают целый спектр нежелательных эффектов, что привело к интенсивному развитию направления синтетической биологии, посвященного созданию скаффолдовых распознающих белков.
За последние 20 лет во многом благодаря технологии синтетических библиотек получены разнообразные каркасные распознающие белки. Как и антитела, эти белки имеют консервативную каркасную часть и вариабельную распознающую часть. Специфически связывающие скаффолдовые белки обычно получают с помощью комбинаторных библиотек, которые содержат наборы генов, различающихся в вариабельной области. В частности, разрабатывают белки на основе доменов липокалинов, цинковых пальцев, src-гомологичных доменов, PDZ-доменов, доменов ингибиторов сериновых протеаз типа Кунитца, цистатинов, ДНК-связывающего белка Sac7d, A-доменов различных мембранных рецепторов, доменов гамма-B-кристаллина и убиквитина, а также ряда других. На сегодняшний день создано более 20 классов миметиков антител, основные представители которых представлены в таблице.
Основные представители скаффолдовых (каркасных) белков – миметиков антител
Белки | Основа белков – скаффолд (каркас) | Молекулярная масса, кДа | Репрезентативные источники |
Авимеры | Домен А внеклеточных рецепторов | 4 | |
Адгироны | Домен фитоцистатина | 10 | [19] |
Аднектины (монободи) | FN3-домен фибронектина | 10 | [20–22] |
Атримеры | Домен CTLD тетранектина | 60–70 | [23] |
Антикалины | Домены липокалина | 20 | |
Аффибоди | Z-домен белка А клеточной стенки золотистого стафилококка | 6 | [26] |
Аффилины | Домены гамма-B-кристаллина / убиквитина | 20 /10 | |
Аффимеры | Домены цистатина – ингибитора цистеиновых протеаз | 12 | |
Аффитины (нанофитины) | Домены ДНК-связывающего белка Sac7d | 7 | [31–33] |
Дарпины | Анкириновый повтор белка дрозофилы | 14–18 | [34–37] |
Кноттины | Богатые дисульфидами пептидные токсины | 3 | [38] |
Ободи | Домен распознавания антикодона из аспартил-тРНК-синтазы | 10 | [39] |
Полипептиды на основедомена Кунитца | Домен Кунитца сериновых протеаз | 6 | [40] |
Пронектины | 14 домен фибронектина человека | 75 | [41] |
Репебоди | Лейцин-богатые повторы вариабельныхрецепторов лимфоцитов | 3–30 | [42] |
Финомеры | SH3-домен киназы Fyn(src-гомологичные домены) | 7 | [43] |
Центирины | Fn3-домены тенасцина-С | 9 | [44] |
ADAPT (ABD-DerivedAffinity Proteins) | Альбуминсвязывающий домен белка G | 5 | [45] |
NanoCLAMP (nano-CLostridial Antibody Mimetic Proteins) | Углеводсвязывающий домен гиалуронидазы C | 16 | [46] |
ARM (ArmadilloRepeat Proteins) | Белки с доменом Armadillo дрозофилы | 39 | [47] |
PDZ-белки | Домены PSD-95/Discs-large/ZO-1 | 10 | [48] |
Представленные белки обладают малым размером (8–20 кДа), высокой аффинностью к молекулярным мишеням (субнано–фемтомолярные значения константы связывания) и оптимальными биохимическими и термодинамическими характеристиками. Они остаются долгое время стабильными при воздействии высоких температур (вплоть до 80°С), при низких значениях pH (вплоть до pH 2) и действии хаотропных агентов. Введение цистеинов в состав этих белков позволяет получать как димеры с заданными характеристиками, так и проводить региоселективную модификацию белков различными соединениями посредством образования дисульфидных связей. Низкая иммуногенность белков, вызванная их синтетической природой, позволяет использовать их в терапевтических целях, особенно в тех случаях, когда одного курса терапии недостаточно для достижения ремиссии и существует необходимость в проведении повторных инъекций препарата.
Все классы данных белков имеют свободные (вне распознающей области) N- и C-концы, что позволяет проводить эффективную химическую конъюгацию белков с полимерами на поверхности наночастиц, а также создавать генно-инженерные конструкции (например, слитые белки, состоящие из скаффолдов и белковых токсинов) для терапевтических применений. Малый размер скаффолдов позволяет значительно увеличить количество их молекул, прикрепляемых к поверхности наночастиц, по сравнению с IgG. На сегодняшний день для доставки наночастиц к молекулярным мишеням наиболее часто используют только дарпины, аффибоди и производные альбуминсвязывающего домена (ABD) (рис. 2). Также проведен ряд исследований, направленных на создание наночастиц для адресной доставки на основе репебоди [49–51], аффимеров [52], аффитинов [53–55] и кноттинов [56].
Рис. 2. Адресные скаффолдовые полипептиды для доставки наночастиц-носителей к клеткам-мишеням.1. – Широкое разнообразие наночастиц, используемых для диагностических и терапевтических задач. 2. – Средства модификации поверхности наночастиц нацеливающими молекулами: физическая адсорбция молекул, химические методы конъюгации, белковые адапторные системы, генно-инженерные методы. 3. – Адресные скаффолдовые белки, уже используемые для адресной доставки наночастиц – дарпины, аффибоди и ADAPT.4. – Задачи, решаемые при адресной доставке наночастиц к рецепторам раковых клеток: диагностика, в том числе мультимодальная, и терапия, в том числе сочетанная
3. ДАРПИНЫ КАК ИНСТРУМЕНТ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ НАНОЧАСТИЦ К МИШЕНЯМ
Дарпины (DARPin, Designed Ankyrin Repeat Protein), или белки c анкириновыми повторами – уникальные инструменты для задач персонифицированной медицины и фундаментальных исследований в области молекулярной и клеточной биологии [57, 58]. В основе этих белков лежат анкириновые повторы – серия плотно упакованных повторов, каждый из которых состоит примерно из 33 аминокислотных остатков. В свою очередь, каждый повтор состоит из двух альфа-спиралей, связанных короткой петлей, и одного бета-поворота, связывающего данный повтор со следующим. Белки с анкириновыми повторами образуют правозакрученный соленоид, в котором имеется протяженный гидрофобный остов и гидрофильная поверхность, доступная растворителю [59]. Они часто опосредуют белок-белковые взаимодействия внутри клетки, например, в качестве белков цитоскелета, инициаторов транскрипции или регуляторов клеточного цикла. В природе обычно встречаются белки с четырьмя–шестью повторами, но иногда число повторов больше 29. Семь аминокислотных остатков из повтора (шесть из бета-поворота и один из спирали) формируют связывающую поверхность; при создании рекомбинантных библиотек в кодоны именно этих остатков вводят случайные замены. Дарпины часто отбирают с применением технологии рибосомного дисплея. Дарпины, как правило, формируют из двух-трех повторов (иногда четырех), последовательно расположенных между N- и C-концами. Молекулярная масса таких каркасных белков зависит от количества повторов и составляет 14–18 кДа, если состоит из двух-трех повторов. Дарпины являются чрезвычайно термостабильными белками, выдерживающими достаточно суровые условия – нагревание до 90°С, действие протеаз и хаотропных агентов. Получены дарпины к мембраноассоциированным онкомаркерам: EpCAM, VEGF-A, HER2, а также к мальтозосвязывающему белку, МАР-киназе, каспазе-2, антителу IgE, а также CD4 [35, 60–62].
Поскольку дарпины формируют достаточно жесткий каркас и распознающую поверхность, при распознавании мишени часто возникают проблемы стерического характера. Для решения этой проблемы разработан новый схожий класс соединений – LoopDARPin с мягкими выступающими распознающими петлями, которые не нарушают структуру самого каркасного белка [63].
3.1. Комплексы магнитных наноструктур с дарпинами для направленной доставки
В цикле работ [64–68] продемонстрирована успешная модификация магнитных наноструктур, представленных суперпарамагнитными наночастицами оксида железа, молекулами DARPin G3 и DARPin 9_29 [69], селективно распознающими клинически значимый онкомаркер HER2 – рецептор эпидермального фактора роста 2 человека. DARPin_G3 связывается с доменом IV рецептора HER2 (расположенного наиболее близко к мембране) с K = 0.070 нМ [61], а DARPin_9.29 – с доменом I рецептора HER2 (наиболее отдаленного от мембраны) с K = 3.8 нМ [34].
Ген ERBB2, кодирующий HER2, играет важную роль в развитии злокачественных опухолей человека. Этот ген амплифицирован примерно в 20–30% случаях рака молочной железы и во многих других типах злокачественных опухолей. Сверхэкспрессия рецептора HER2 часто коррелирует с высоким метастатическим потенциалом опухоли, устойчивостью к химиотерапии, а также предсказывает высокий риск рецидива болезни и снижение общей выживаемости пациентов.
Молекула HER2 уже используется как мишень для адресной терапии рака молочной железы и желудка с использованием гуманизированных анти-HER2-антител: трастузумаба (Herceptin, Herclon) и пертузумаба (Perjeta, Omnitarg) [70, 71]. К сожалению, механизмов, связанных с привлечением к раковым клеткам молекулы комплемента и цитотоксических лейкоцитов, недостаточно, чтобы полностью элиминировать опухоль, что требует создания адресных агентов, содержащих дополнительные токсичные соединения. Так, при HER2-положительном раке молочной железы и желудка применяется трастузумаб, конъюгированный с ингибитором сборки микротрубочек (трастузумаб-эмтанзин, Кадсила), который действительно повышает эффективность терапии HER2-положительных опухолей.
Существует острая необходимость в новых, более эффективных методах тераностики данного заболевания. Наночастицы, обладающие диагностическими и терапевтическими свойствами, направленные на рецептор HER2, представляются одними из наиболее перспективных инструментов для разработки новых стратегий терапии опухолей.
Магнитные наночастицы с дарпинами DARPin G3 и DARPin 9_29 показали свою эффективность для тераностики HER2-положительных опухолей. Так, методом химической конъюгации получены комплексы магнитных наночастиц–DARPin G3, направленных на HER2 на поверхности линии клеток SK-BR-3, аденокарциномы молочной железы человека. В результате стали возможными флуоресцентная и магниторезонансная визуализация HER2-сверхэкспрессирующих опухолей in vivo [64].
Использование химической конъюгации дарпина DARPin 9_29 с магнитными частицами не позволило добиться селективного связывания наночастиц с клетками-мишенями [67, 68]. Видимо, при прямой конъюгации молекул малого размера с поверхностью наночастиц возникают такие проблемы, как 1) частичная денатурация белка на поверхности наночастицы, 2) связывание посредством нескольких аминогрупп и неориентированное присоединение, 3) стерические затруднения при распознавании мишени. Эти проблемы решены с помощью белковых адапторных систем. В частности, в качестве посредника между поверхностью наночастиц и молекулой дарпина использовали высокоаффинную белковую пару барназа–барстар.
Пара барназа–барстар является уникальным инструментом для создания мультифункциональных средств биомедицины [72–74]. Барстар (10 кДа) – природный ингибитор бактериальной рибонуклеазы барназы (12 кДа). Эти белки обладают исключительно высокой аффинностью (константа ассоциации Kас ~ 1014 М–1) и быстрой кинетикой взаимодействия (константа скорости образования комплекса kon ~ 108 М–1с–1), а их отсутствие в клетках млекопитающих позволяет использовать эти белки в кровотоке без возможных проблем, связанных с конкурентным связыванием с эндогенными компонентами крови. Небольшой размер и высокая константа ассоциации делают их идеальным «молекулярным клеем» для создания различных самособирающихся структур на основе различных модулей, где в состав одного модуля (например, терапевтического) входит один компонент системы (например, барстар), а в состав другого (например, дарпин) – другой (например, барназа). Подобный «лего»-подход позволяет избежать таких стандартных проблем химической конъюгации компонентов с наноструктурами и делает возможным получение биологически активных структур путем простого смешивания компонентов, например: наночастица–барстар + барназа–дарпин.
В частности, разработан новый универсальный метод биомодификации наноструктур различной природы, заключающийся в использовании пептидов, связывающих твердую фазу, и белкового модуля барназа–барстар [68]. Метод включает нековалентную модификацию поверхности наночастиц пептидом, связывающим SiO2-поверхность наночастиц (VKTQATSREEPPRLPSKHRPG)4VKTQTAS (silica binding peptide, SBP), генно-инженерно слитого с барстаром (SBP-Bs). Эффективность предложенного метода подтверждена получением флуоресцентных и магнитных наночастиц, модифицированных дарпином DARPin 9_29, распознающим онкомаркер HER2, и адресной доставкой данных наночастиц к раковым клетками со сверхэкспрессией HER2. Для реализации этого подхода получены и охарактеризованы слитые белки, состоящие из SiO2-связывающего полипептида и барстара (SBP-Bs), а также DARPin 9_29 и барназы (DARPin 9_29-Bn). В обоих белках функциональные модули связаны гибким пептидным линкером для сохранения функциональной активности, устойчивым к действию протеаз. Адресные наночастицы получали путем самосборки двух компонентов – наночастиц с барстаром и адресного дарпина с барназой. Для распознавания мишени – рецептора HER2 на поверхности клеток – такой подход оказался гораздо эффективнее химической конъюгации.
Этот подход обладает универсальностью: можно легко заменять компоненты адапторной системы, содержащие как барназу, так и барстар. Описано 12 способов адресной доставки наночастиц, различным образом модифицированных адресными полипептидами через барназу–барстар [68]. В качестве полипептида, опосредующего связь белка адапторной системы барназа–барстар с поверхностью наночастицы, использовали также С-концевой фрагмент белка Mms6 – одного из белков оболочки магнитосом магнитотактических бактерий [67]. Самособранные конструкции на основе наночастиц магнетита МЧ–Bs-C-Mms6–DARP 9_29-Bn использовали для адресной доставки к сверхэкспрессирующим HER2 клеткам SK-BR-3. Показано, что такие конструкции эффективны для селективного мечения и визуализации HER2-положительных клеток in vitro [65, 67].
3.2. Модификация золотых наноструктур дарпинами
У наноразмерных объектов появляются необычные квантово-химические свойства, отличные от свойств массивных образцов, которые позволяют создавать мультифункциональные средства терапии и диагностики [75–78]. Одно из таких интересных свойств – эффект локализованного поверхностно-плазмонного резонанса (ЛППР) у наноструктур золота и серебра, а также у гибридных наноструктур (например, типа ядро/оболочка).
Явление ЛППР основано на резонансном возбуждении плазмонов – квазичастиц, представляющих собой кванты колебаний свободных электронов на границе раздела двух фаз с различающимися показателями преломления при соблюдении условия полного внутреннего отражения. Если выполнены условия ЛППР, то интенсивность отраженного света резко уменьшается в связи с переходом энергии падающей электромагнитной волны в энергию плазмона. Поглощенная энергия может переходить в тепловую, реализуя тем самым гипертермические свойства образца с ЛППР, которые могут применяться в терапии опухолей, клетки которых обладают повышенной чувствительностью к нагреванию.
Фундаментальные исследования направлены на изучение свойств наноструктур с ЛППР в основном из золота и серебра, а также из других менее традиционных материалов, таких, как алюминий, медь, палладий, платина. В частности, получены наночастицы золота размером 5 нм, модифицированные DARP 9_29 [79]. Нековалентная стабилизация непокрытых наночастиц золота молекулами DARP 9_29 позволила получить коллоидно стабильные комплексы с адресными молекулами, селективно распознающими поверхность раковых клеток, экспрессирующих рецептор HER2. Схожий метод модификации использован для получения золотых наностержней длиной 50 нм и диаметром 7 нм для адресной доставки к HER2-положительным клеткам in vitro и их селективного уничтожения посредством фототермически индуцированной локальной гипертермии при возбуждении светом с длиной волны 850 нм и мощностью 30 мВт/см2 в течение 20 мин [80]. Эффективность разработанных адресных наностержней для локальной гипертермии подтверждается практически 100% гибелью только HER2-сверхэкспрессирующих клеток при облучении светом, в то время как необлученные клетки и клетки с незначительной экспрессией HER2 остаются полностью жизнеспособными.
3.3. Модификация апконверсионных наноструктур дарпинами
Апконверсионные наноструктуры (антистоксовые нанофосфоры) – фотолюминесцентные наночастицы, преобразующие электромагнитное излучение с более низкой энергией (большей длины волны) в электромагнитное излучение с большей энергией (меньшей длиной волны) [81–85]. Антистоксовые нанофосфоры представляют собой кристаллы NaYF4, легированные редкоземельными элементами, а именно Yb3+, Er3+, Tm3+. Такие наноструктуры поглощают несколько низкоэнергетичных фотонов и переиспускают один более высокоэнергетичный фотон, реализуя тем самым явление апконверсии, когда длина волны испускания сдвигается в более коротковолновую область (синий сдвиг, антистоксов сдвиг), в то время как в большинстве процессов флуоресценции в живых системах реализуется стоксов сдвиг (красный сдвиг). Нанофосфоры синтезируют таким образом, чтобы возбуждение происходило в окне прозрачности биоткани (около 980 нм), а испускание – в коротковолновом диапазоне, подходящем для большинства визуализирующих устройств для работы с живыми объектами in vitro и in vivo. Антистоксовые нанофосфоры служат прекрасными метками для визуализации in vivo, поскольку благодаря длительной фотолюминесценции и разрешенной по времени регистрации сигнала существует возможность полностью исключить аутофлуоресценцию биоткани и получить истинный сигнал без шума с высокой чувствительностью, вплоть до регистрации одиночной частицы.
Нанофосфоры состава ядро/оболочка = NaYF4:Yb,Er,Tm/NaYF4, были покрыты анти-HER2 дарпином DARPin 9_29 и использованы для адресной доставки к HER2-положительным раковым клеткам в культуре и визуализации ксенотрансплантатов опухоли у животных в течение как минимум 24 ч. Проведено исчерпывающее доклиническое исследование общей и специфической токсичности таких наноструктур, включая оценку их аллергенных, иммунотоксических и репротоксических свойств. Полученные экспериментальные данные позволяют сделать вывод о том, что как безадресные, так и адресные нанофосфоры являются функциональными, нецитотоксичными, биосовместимыми и безопасными для визуализации клеток in vitro и опухолей in vivo [86–88].
С целью придания нанофосфорам дополнительной терапевтической модальности их поверхность модифицировали белком DARPin 9_29, слитым генно-инженерными методами с низкоиммуногенным фрагментом псевдомонадного экзотоксина A – LoPE [89]. Полученный белок DARP-LoPE обладает всеми необходимыми для тераностики свойствами – адресным взаимодействием с клетками-мишенями и цитотоксичностью при связывании с клетками.
Экзотоксин А синегнойной палочки Pseudomonas aeruginosa (PE, ETA) – один из наиболее эффективных индукторов апоптоза за счет ферментативной активности, угнетающей трансляцию. PE состоит из трех доменов – домен I отвечает за связывание и проникновение токсина в клетку, домен II участвует во внутриклеточном транспорте токсина, домен III обладает собственной ферментативной активностью – АDP-рибозилирует эукариотический eEF2, блокируя тем самым биосинтез белка в клетке, что в итоге приводит к ее гибели [90]. Для создания эффективных иммунотоксинов на основе PE используют укороченные варианты данного токсина, а именно, непосредственно каталитический домен, соединенный с направляющими модулями различной специфичности. Получены иммунотоксины на основе дарпинов, узнающих HER2, соединенные с одним из вариантов C-концевого (эффекторного) фрагмента PE (LoPE), в составе которого мутированы иммунодоминантные эпитопы В-лимфоцитов человека [91]. Иммуногенность и системная токсичность такого фрагмента ниже, чем у немодифицированного фрагмента.
Адресный цитотоксичный белок – иммунотоксин DARP-LoPE, конъюгировали с поверхностью антистоксовых нанофосфоров с помощью карбодиимида и промежуточного линкера – полиэтиленгликоля. Изначально синтезированные нанофосфоры были покрыты ПМАО – чередующимся сополимером малеинового ангидрида с 1-октадеценом, и для придания большей коллоидной стабильности – полиэтиленгликолем [89]. Цитотоксичность адресных комплексов нанофосфор–ПЭГ–DARP-LoPE изучена на клетках SK-BR-3-Kat. Значение IC50 таких комплексов равно 0.4 мкг/мл, а в контрольных клетках CHO, не экспрессирующих HER2, IC50 = 200 мкг/мл, что подтверждает адресную цитотоксичность полученных соединений.
Адресная цитотоксичность значительно усиливалась при использовании иттрия-90 как бета-эмиттера в составе нанофосфоров. Синтезированы радиоактивные антистоксовые нанофосфоры с бета-излучателем (время полураспада которого составляет 63 ч, что оптимально для биомедицины) и модифицированные белком слияния DARP 9_29 c фрагментом псевдомонадного экзотоксина А, PE [92]. Объединение двух терапевтических модальностей в составе одной наночастицы приводит к сильному синергическому действию: IC50 составило 5.2 мкг/мл для адресных наночастиц, 140 мкг/мл для наночастиц, допированных иттрием-90, в случае наночастиц с адресным модулем и иттрием-90 наблюдали существенное снижение полумаксимальной ингибирующей концентрации: IC50 = 0.0024 мкг/мл [92].
3.4. Комплексы липидных наноструктур и дарпинов
В качестве объектов исследований для задач онкотераностики использовали такие липидные структуры, как однослойные липосомы и экзосомы.
Получены липосомы размером 117 ± 41 нм, загруженные РНКазой – барназой, и химически конъюгированные с анти-HER2 дарпином 9_29 [93, 94]. РНКазы представляют интерес как немутагенная альтернатива стандартным химиотерапевтическим препаратам. Однако многие РНКазы млекопитающих не являются сильнодействующими токсинами, поскольку их существенно подавляет ингибитор рибонуклеазы, присутствующий в цитоплазме клеток млекопитающих. Рибонуклеаза барназа выгодно отличается тем, что она не обладает мутагенной активностью, не вызывает сильных побочных токсических эффектов и, проникнув в клетку, расщепляет РНК, вызывает ее гибель. Активность барназы не подавляется человеческим ингибитором рибонуклеаз. Барназа вызывает деградацию РНК с низкой молекулярной массой, а именно тРНК и 5.8S рРНК (но не 5S рРНК). При интернализации барназа вызывает блеббинг клеточных мембран и апоптоз путем межнуклеосомного расщепления хроматина. С использованием липосом, загруженных барназой и модифицированных анти-HER2 дарпином, установлена эффективность терапии HER2-положительных ксенографтных опухолей BT474 у лабораторных животных. IC50 барназы в составе адресных липосом составила 0.11 нМ для клеток BT474 в культуре in vitro, эффективность ингибирования опухолевого роста in vivo составила 84%. Комбинирование адресных липосом с адресным иммунотоксином на основе LoPE и дарпина EC1 привело к подавлению опухолевого роста на 91.8% и полному предотвращению появления метастазов [94].
DARP EC1 связывается с рецептором EpCAM с пикомолярной аффинностью (Кд = 68 пМ). EpCAM – трансмембранный гликопротеин с молекулярной массой 40 кДа, состоящий из 314 аминокислотных остатков, впервые обнаружили как опухолевый антиген в клетках рака толстой кишки в 1979 году. Основная функция EpCAM заключается в обеспечении межклеточного взаимодействия. Молекула EpCAM также часто экспрессируется на клетках рака молочной железы человека, что ассоциировано с плохим прогнозом. Так, по результатам обширного исследования экспрессия EpCAM обнаруживается в 48% случаев рака молочной железы человека [95]. При этом, как и HER2, EpCAM уже применяют в качестве мишени при иммунотерапии моноклональными антителами (препаратом Ремоваб). В связи с этим, перспективным представляется комбинирование различных методов воздействия на злокачественные опухоли с помощью скаффолдовых белков, направленных как на HER2, так и на EpCAM, для разработки эффективных стратегий терапии опухолей.
Наряду с липосомами, загруженными барназой, получены 90-нм липосомы, загруженные PE40 и модифицированные DARP 9_29 [96]. Эти липосомы использовали для селективного уничтожения HER2-сверхэкспрессирующих клеток (IC50 = 0.17 нМ для клеток SK-BR-3 и 0.21 нМ для клеток SK-OV-3) [96].
Изящным подходом к созданию адресных липидных наночастиц является использование природных механизмов получения уже модифицированных наночастиц, не требующих применения методов химической конъюгации. В частности, описано получение экзосом из клеток HEK293T, трансдуцированных лентивирусом со вставкой гена дарпина DARP G3, распознающего рецептор HER2 [97]. Такие экзосомы специфично связывались с клетками SK-BR-3 и адресно доставляли малые интерферирующие РНК против гена TPD52, что приводило к подавлению экспрессии гена на 70% [97].
3.5. Доставка нуклеиновых кислот с использованием дарпинов
Показано, что дарпины могут применяться для адресной доставки генного материала в клетки эукариот. Получены лентивирусы, экспонирующие дарпины DARP G3, DARP H14R, DARP 9_29, DARP 9_26, DARP 9_16, DARP 9_01 на своей поверхности, нацеленные на рецептор HER2 [98]. При этом DARPin 9_29 оказался наиболее эффективным как по представленности на поверхности вируса, так и по трансдукции HER2-положительных клеток. Дарпины оказались эффективнее ранее используемого мини-антитела scFv – одноцепочечного фрагмента легкой и тяжелой цепи иммуноглобулина 4D5, направленного на рецептор HER2 [98].
Дарпины использовали для доставки малых интерферирующих РНК, комплементарных мРНК регулятора апоптоза Bcl-2 [99]. Применяли димеры дарпина EC1, слитые с протамином-1 – небольшим белком, формирующим комплекс с нуклеиновыми кислотами. Такой белок связывал четыре-пять молекул малых интерферирующих РНК и сохранял специфичность связывания с рецептором EpCAM на поверхности клеток MCF-7. Это позволило адресно трансфицировать только EpCAM-сверхэкспрессирующие раковые клеток и добиться эффективного подавления биосинтеза Bcl-2 [98].
4. АФФИБОДИ КАК ИНСТРУМЕНТ ДЛЯ НАПРАВЛЕННОЙ ДОСТАВКИ НАНОЧАСТИЦ К МИШЕНЯМ
Аффибоди содержат Z-домен белка А золотистого стафилококка Staphylococcus aureus, состоящий из 58 аминокислотных остатков, формирующих три α-спирали, образующих бочонок. Аффибоди выдерживают действие высоких температур (около 90°C), они устойчивы к протеолизу, а также к кислым и щелочным условиям (pH от 2.5 до 11). В настоящее время получен спектр аффибоди к целому ряду молекулярных мишеней: рецепторам HER1, HER2, к TNF-α. Наиболее интенсивно изучают аффибоди ZHER2:342 (известное также, как ABY-002), распознающее рецептор HER2 с Кд = 22 пМ [26]. Аффибоди ZHER2:342 связывается с субдоменом I рецептора HER2, не конкурируя с другими соединениями, направленными на HER2 – антителами трастузумабом или пертузумабом, что открывает широкие возможности в тераностике онкологических заболеваний.
4.1. Модификация магнитных наноструктур аффибоди
Аффибоди – одни из наиболее эффективных каркасных белков, используемых для нацеливания наночастиц на клетки эукариот. Проведено сравнительное исследование эффективности различных анти-HER2 нацеливающих молекул для доставки магнитных наночастиц размером 25 нм, стабилизированных карбоксиметилдекстраном, к HER2-положительным клеткам [66]. Именно наночастицы, модифицированные аффибоди, наиболее пригодны как для магнитной детекции, так и для флуоресцентной визуализации клеток с использованием наночастиц. Это обусловлено малым размером аффибоди ZHER2:342 (8 кДа) по сравнению с другими молекулами – дарпином DARP G3 (14 кДа) и антителом трастузумаб (150 кДа), что позволяет присоединять большее количество активных молекул к поверхности наночастиц [66].
Эффективность аффибоди подтверждается результатами, полученными в большом количестве фундаментальных работ [100, 101]. Для визуализации и магнитно-резонансного контрастирования EGFR- и HER2-положительных клеток in vitro и in vivo создан набор частиц. Получены 27-нм суперпарамагнитные наночастицы оксида железа, допированные лантаноидами для мультиплексного анализа связывания наночастиц с клетками методом масс-спектрометрии с индуктивно-связанной плазмой. К таким наночастицам методом безмедной клик-химии присоединяли анти-HER2-аффибоди [102].
Реакции, относящиеся к клик-химии (биортогональные реакции), имеют исключительно высокий выход, они региоселективны и протекают в различных условиях, в том числе в физиологических. Одна из наиболее часто используемых клик-реакций – азид-алкиновое циклоприсоединение с использованием меди (I) в качестве катализатора [103–105]. Поскольку азидные и алкиновые группы в белковых молекулах, как правило, не представлены, введение этих групп в конъюгируемые компоненты и использование данной реакции позволяют осуществлять полный контроль над селективностью и эффективностью конъюгации.
Суперпарамагнитные 7-нм наночастицы (SPIO) в составе 50-нм микроэмульсий, сформированных посредством амфифильных красителей (в том числе фотосенсибилизаторов) – индоцианинового зеленого (ICG) и протопорфирина IX (PpIX), использовали для адресной доставки in vitro [106]. SPIO 30 нм, модифицированные анти-HER2-аффибоди методом клик-химии, использовали для магнитно-резонансного контрастирования T6–17 HER2-сверхэкспрессирующих опухолей [107]. При этом количество молекул аффибоди, присоединяемых к наночастицам, должно быть оптимальным для распознавания мишени и достижения максимального МРТ-контраста. Так, определение количества молекул аффибоди на поверхности наночастиц после клик-реакции показало, что наиболее эффективны наночастицы 30 нм SPIO, несущие на поверхности 23 молекулы анти-HER2-аффибоди (в тестируемом диапазоне от 6 до 36 молекул) [108].
Мультифункциональность магнитных наноструктур использовали также для тримодальной визуализации 24-нм гетероструктурами, состоящими из наночастиц оксида железа Fe3O4 и золота, и хелатированных 64Cu. С помощью наночастиц, конъюгированных с анти-EGFR-аффибоди ZEGFR:1907 карбодиимидным методом, проведена оптическая, ПЭТ и МРТ-визуализация EGFR-сверхэкспрессирующих опухолей у лабораторных животных [109]. Также осуществлена тримодальная визуализация опухолей с применением компьютерной томографии, ультразвуковой детекции и МРТ-визуализации. С этой целью использовали 10-нм магнитные наночастицы, конъюгированные с анти-HER2-аффибоди ZHER2:342 и меченные ближним ИК-красителем NIR-830 [110, 111]. Впоследствии эти частицы, загруженные цисплатином, использовали для фототермически-индуцированной терапии HER2-положительных опухолей in vivo [112].
Магнитные частицы, модифицированные аффибоди ZIGF1R:4551 (распознающим IGF-1R), использовали как для МРТ-контрастирования, так и для фотоиндуцированной гипертермии опухолей SW620 при облучении светом с длиной волны 808 нм [113].
4.2. Модификация золотых наноструктур аффибоди
Наночастицы золота (140 нм), покрытые оболочкой кремния, модифицированные анти-EGFR-аффибоди ZEGFR:1907 через гетеробифункциональное малеимидное производное ПЭГ, использовали для селективного мечения EGFR-сверхэкспрессирующих клеток в культуре и визуализации опухолей ex vivo [114]. Комплексы наночастицы–клетки выявляли с использованием как флуоресцентной микроскопии, так и с помощью поверхностно-усиленной рамановской спектроскопии [114]. Показано, что такие наночастицы обладают слабой токсичностью для здоровых мышей, что подтверждено определением биохимических показателей, иммуногистохимическим анализом, измерением сердечных параметров в течение 2 недель после системного введения наночастиц [115]. В ряде исследований созданы адресные наночастицы золота для диагностики [110, 116] и терапии HER2-сверхэкспрессирующих опухолей [112, 117].
Наряду со способностью усиливать контраст в рамановской спектроскопии, наночастицы золота являются эффективными сенсибилизаторами рентгеновского излучения. С использованием карбодиимидного метода получены 56-нм наночастицы золота, покрытые анти-HER2-аффибоди [118]. При воздействии рентгеновского излучения (в дозе 10 Гр) такие частицы обладают HER2-специфичной цитотоксичностью, при этом наиболее чувствительными среди тестируемых клеточных линий (SK-BR-3, SK-OV-3, HN-5, MCF-7) оказались HER2-положительные клетки SK-OV-3, выживаемость которых под действием адресных наночастиц и рентгеновского излучения снижалась на 63% [118].
Для достижения максимальной эффективности диагностики (тримодальная визуализация) и терапии (фотоиндуцированной гипертермии опухоли) синтезированы 12-нм янус-частицы состава Au-Fe2C. Эти частицы были покрыты анти-HER2-аффибоди ZHER2:342 и использованы для тримодальной детекции опухоли in vivo: МРТ-визуализации, фотоакустической томографии и компьютерной томографии, и для 808-нм индуцированной гипертермии раковых клеток in vivo на моделях ксенотрансплантатов со сверхэкспрессией рецептора HER2 [119].
Более изящный подход к получению наночастиц с узким распределением по размеру разработан на основе белковых наночастиц, формируемых капсидом вируса гепатита B, экспонирующего на своей поверхности молекулы аффибоди. Проводили восстановление золота, которое приводило к формированию 1–3-нм золотых наночастиц на поверхности уже полученных вирусных частиц. Такие гетероструктуры размером 40 нм, специфичные к EGFR, эффективны как для визуализации раковых клеток посредством Cy5.5 метки, так и для воздействия гипертермии на клетки опухолевой линии MDA-MB-468 сверхэкспрессирующих EGFR [120].
4.3. Модификация антистоксовых наноструктур аффибоди
Апконверсионные наночастицы являются эффективными диагностическими средствами. Они позволяют визуализировать биологические объекты без значительного влияния аутофлуоресценции с высокой чувствительностью [121]. Получены наночастицы состава NaYF4:Tm+3,Yb+3, ковалентно модифицированные анти-EGFR-аффибоди, для визуализации EGFR-экспрессирующих опухолей in vivo [122]. Для фотодинамической терапии EGFR-сверхэкспрессирующих опухолей синтезированы апконверсионные наночастицы с более сложной архитектурой [123]. Получены комплексные суперструктуры с апконвертирующим ядром состава NaYF4,Yb,Er, окруженным металл-органическими каркасными структурами на основе цинка. Самосборку таких структур осуществляли с использованием комплементарных цепей ДНК. При возбуждении таких структур внешним ИК-светом апконверсионное ядро испускает свет видимого диапазона, тем самым возбуждая металл-органические каркасы, способные продуцировать активные формы кислорода, выступая таким образом в качестве терапевтических соединений [123].
4.4. Аффисомы
Соединения на основе липосом, модифицированных аффибоди, получили название аффисом [124, 125]. Для терапии HER2- и EGFR-положительных опухолей получен ряд липосом, ковалентно модифицированных анти-HER2-аффибоди ZHER2:342 [126], а также через полиэтиленгликолевый линкер: анти-HER2-аффибоди ZHER2:477 [124], (Z00477)2-Cys [127] и анти-EGFR-аффибоди (ZEGFR:955)2 [128].
4.5. Комплексы полимерных наноструктур и аффибоди
Для синтеза наночастиц используются разнообразные материалы (золото, углерод, магнетит, кремний и др.), среди которых по структурным и функциональным характеристикам выделяются биосовместимые полимеры, например, уже применяемый в диагностике и терапии полилактид-когликолид (PLGA). PLGA постепенно разлагается до молочной и гликолевой кислот и выводится из организма. Синтезированы разнообразные полимеры PLGA, содержащие свободные карбоксильные и аминогруппы, что открывает широкие возможности модификации частиц молекулами, узнающими опухолевые антигены. Получены 140-нм наночастицы PLGA, загруженные флуоресцентным красителем Nile Red и доксорубицином. Эти наночастицы стабилизировали хитозаном и конъюгировали с анти-HER2-аффибоди ZHER2:342 с использованием EDC/сульфо-NHS. Наночастицы PLGA–ZHER2:342 использовали для мечения HER2-сверхэкспрессирующих раковых клеток как in vitro, так и in vivo. Специфичность этих наночастиц была более чем в 60 раз выше, чем у контрольных ненаправленных наночастиц. Наночастицы PLGA–ZHER2:342 применяли для воздействия на клетки по отдельности или в сочетании с адресным бифункциональным иммунотоксином DARP-LoPE (42 кДа). Показано, что комбинированная терапия с использованием DARP-LoPE и PLGA–ZHER2:342 снижает эффективную концентрацию иммунотоксина в 1000 раз in vitro. Подобная стратегия двойного нацеливания улучшила эффективность противоопухолевой терапии HER2-позитивных клеток in vivo [6]. Метод синтеза и поверхностной модификации использовали в дальнейшем для создания наночастиц, загруженных фотосенсибилизатором Rose Bengal, которые при облучении светом с длиной волны 532 нм продуцируют активные формы кислорода, приводящие к гибели HER2-сверхэкспрессирующих раковых клеток [129].
Активно исследуются также наночастицы, состоящие из гибридных полимеров. Получены полимерные наночастицы из блок-сополимера полилактид-когликолида и полиэтиленгликоля, которые были модифицированы анти-HER2-аффибоди ZHER2:342 с использованием малеимидного метода химической конъюгации и загружены паклитакселом. Такие наночастицы использовали для селективного уничтожения HER2-сверхэкспрессирующих клеток in vitro [130].
Разработано большое количество наночастиц, в которых полимер служит матрицей для синтеза и включения в состав как растворимых, так и нерастворимых соединений. При этом сами полимерные материалы могут иметь диагностическую и терапевтическую значимость – обладать флуоресценцией либо способностью к фототермической конверсии [131]. Так, для тераностики созданы 30-нм наночастицы на основе полимеров поли[9,9-бис(2-(2-(2-метоксиэтокси)этокси)этил)фторенилдивинилен]-альт-4,7-(2,1,3-бензотиадиазол)а, обладающего флуоресценцией в ближнекрасном диапазоне и свойствами фотосенсибилизатора, и поли[(4,4,9,9-тетракис(4-(октилокси)фенил)-4,9-дигидро-втор-индаценол-дитиофен-2,7-диил)-альт-со-4,9-бис(тиофен-2-ил)-6,7-бис(4-(гексилокси)фенил)тиадиазоло-хиноксалина] с сильным поглощением в ближней инфракрасной области и отличной способностью к фототермической конверсии. Такие частицы обладали 60.4% квантовым выходом и эффективной фототермической конверсией – 47.6%. Показано, что применение двух видов воздействия – фотодинамического и фототермического – приводит к синергическому эффекту при терапии опухоли [132, 133]. Также получены 30-нм сверхразветвленные, флуоресцентные, полиэлектролитные комплексы состава ядро/оболочка. В качестве ядра использовали флуоресцентный полимер с максимумом испускания при 565 нм, полученный полициклотримеризацией алкинов, а в качестве оболочки – полиэтиленгликоль. Такие полиэлектролитные комплексы покрывали анти-HER2-аффибоди методом карбодиимидной конъюгации и использовали как эффективные флуоресцентные метки для визуализации клеток SK-BR-3 [134].
Среди полимерных наноматериалов выделяется уникальный класс контрастирующих соединений – нанопузырьки, которые используются для ультразвукового контрастирования in vivo [135]. Так, получены 480-нм нанопузырьки, состоящие из фосфолипидной оболочки и наполненные газом C3F8, покрытые анти-HER2-аффибоди через систему стрептавидин–биотин [136].
Частицы разной формы (80×320 и 55×60 нм), синтезированные с помощью технологии репликации в несмачиваемых молдах (PRINT, particle replication in nonwetting templates), были модифицированы анти-EGFR-аффибоди с различной плотностью аффибоди на поверхности наночастиц. При этом in vivo отмечены значительные различия в накоплении наночастиц обоих типов в опухоли в зависимости от плотности аффибоди. Максимальное отношение содержания наночастиц в опухоли и в крови наблюдали для частиц с максимальным количеством лиганда [137].
4.6. Комплексы белковых наночастиц и аффибоди
Биосовместимость и биодеградируемость белковых наночастиц делают их лидерами при переходе в клиническую практику в качестве диагностических и терапевтических препаратов. При этом успехи генетической инженерии позволяют получить полностью генетически кодируемые слитые белки с нужными функциональными характеристиками без необходимости использования методов химической конъюгации.
Одни из самых популярных белковых наночастиц – наночастицы на основе альбумина. Наночастицы альбумина были модифицированы анти-HER2-аффибоди с использованием бактериального суперклея – белковой адапторной системы SpyTag (ST)/SpyCatcher (SC), полученной из сплит-белка CnaB2 Streptococcus pyogenes. SpyTag – 13-аминоксилотный пептид, и SpyCatcher – 15 кДа белок, формируют при связывании ковалентную пептидную связь. Систему SpyTag/SpyCatcher использовали в качестве молекулярного посредника между поверхностью наночастиц и молекулой аффибоди, гарантируя таким образом региоселективное присоединение аффибоди к наночастице практически со 100% эффективностью. Такие наночастицы были загружены фотосенсибилизатором индоцианиновым зеленым и использованы для фототермически-индуцированной гибели HER2-сверхэкспрессирующих раковых клеток [138].
Систему SpyTag/SpyCatcher также успешно использовали для модификации наночастиц на основе инкапсулина [139, 140] и люмазинсинтазы [141]. Инкапсулин (Encap) – это формирующий наночастицы относительно недавно изученный белок, выделенный из термофильных бактерий Thermotoga maritima. Получен слитый белок – инкапсулин–SpyTag, формирующий 35-нм наночастицы с одним из элементов адапторной системы, ST [140]. Получены также слитые белки анти-HER2–анти-EGFR-аффибоди со вторым компонентом белковой пары, а именно SC. Эти слитые белки флуоресцентно метили двумя различными красителями, легировали с наночастицами и проводили специфичную бимодальную флуоресцентную детекцию клеток с различным уровнем экспрессии HER2 и EGFR [140]. Аналогичным образом полученные наночастицы на основе люмазинсинтазы Aquifex aeolicus (AaLS) и загруженные комплексом гадолиния (Gd(III)-DOTA) использовали для МРТ-контрастирования опухолей с различной экспрессией HER2 и EGFR у мышей [141].
Самособирающиеся белковые наночастицы на основе, например, капсида вируса гепатита B часто используют для доставки как генов, так и белков [142–148]. Получены 28-нм наночастицы на основе вирусного капсида, загруженные дальнекрасным флуоресцентным белком mCardinal и модифицированные анти-HER2-аффибоди. Тесты in vivo показали, что в опухоли частицы накапливаются активно, а в печени значительно слабее, чем наночастицы с традиционными красителями, а именно Cy5.5 [142].
Получены 12-нм наночастицы из ферритина человека, состоящие из 24 субъединиц тяжелых цепей ферритина, генно-инженерно слитых с анти-EGFR-аффибоди. Такие частицы метили ближнекрасным красителем Cy5.5 и использовали для визуализации EGFR-сверхэкспрессирующих клеток [149]. Для более длительной циркуляции наноструктур ферритина в кровотоке in vivo применяли модификации: в структуру вводили гидрофобные последовательности, формирующие гидратную оболочку сродни эффекту ПЭГилирования наночастиц [150]. Применение такого подхода позволило повысить накопление наночастиц в опухоли в 2 раза, что подтверждено с помощью прижизненной визуализации in vivo с использованием красителя Cy5.5 [150].
Установлено, что 90-нм мезопористые кремниевые наночастицы, загруженные кампотецином и покрытые белковой короной из слитого белка глутатион-S-трансфераза/анти-HER2-аффибоди, в значительно меньшей степени связываются с белками сыворотки крови, тем самым минимизируя процессы поглощения наночастиц макрофагами [151]. Такие частицы, меченные флуоресцентным красителем DiI и загруженные кампотецином – цитотоксическим хинолиновым алкалоидом, ингибирующим топоизомеразу I, применяли для визуализации и ингибирования опухолевого роста in vivo, эффективность которого составила 90% [151].
4.7. Модификация ДНК-тетраэдных комплексов молекулами аффибоди
Большое количество исследований посвящено разработке систем адресной доставки генетического материала. Например, молекулы анти-HER2-аффибоди ZHER2:2891, связанные с сополимером полиэтиленгликоля и полиэтиленимина, использованы для доставки гена люциферазы в клетки BT474, сверхэкспрессирующие HER2. Показано, что интенсивность люминесценции трансфицированных HER2-сверхэкспрессирующих клеток была более чем в 300 раз выше, чем у контрольных клеток MDA-MB-231 с умеренной экспрессией HER2 [152].
ДНК может быть носителем не только генетической информации, но и химиотерапевтических препаратов. В частности, в роли каркасов выступают ДНК-тетраэдры – трехмерные структуры, получаемые из двойных спиралей ДНК длиной 20 п.н. методом ДНК-оригами. Оказалось, что ДНК-тетраэдры, химически модифицированные анти-HER2-аффибоди малеимидным методом конъюгации и нагруженные доксорубцином (53 молекулы доксорубицина на один комплекс) [153], значительно сильнее ингибировали рост клеток, чем доксорубицин, проявляя при этом гораздо меньшую токсичность в отношении клеток с нормальным уровнем HER2. Аналогичные наночастицы, загруженные цисплатином (68 молекул цисплатина на одну наночастицу), использованы для селективного уничтожения HER2-положительных клеток практически со 100% эффективностью [154].
Получен также слитый белок, состоящий из аффибоди ZHER2:342 и пептида RALA – эффективного невирусного средства доставки нуклеиновых кислот в клетки. Аффибоди и пептид были соединены гибким глицин-сериновым линкером, устойчивым к действию протеаз (G4S)3. Полученный слитый пептид ассоциирован с FUdR15 – последовательностью из 15 остатков 5-фтордезоксиуридина, метаболитом которого является химиотерапевтическое соединение – 5-фторурацил [155]. Полученная система адресно воздействует на клетки со сверхэкспрессией рецептора HER2 N87, вызывая их гибель по механизму апоптоза [155]. Впоследствии механизмы адресной доставки, разработанные в рассмотренных работах [154, 155], были объединены в систему доставки FUdR на основе ДНК-тетраэдров к клеткам опухоли, полученным инъекцией клеток BT474, использование которых привело к замедлению роста опухоли примерно в 2.5 раза [156].
4.8. Модификация квантовых точек аффибоди
Квантовые точки – флуоресцентные полупроводниковые нанокристаллы с размером ядра 1–12 нм, синтезированные из элементов II и VI групп (например, ZnS, CdSe или CdTe), реже III и V групп (InP) или IV и VI групп (PbS, PbSe, PbTe) Периодической системы Д.И. Менделеева. От традиционных флуорофоров, таких, как органические красители и флуоресцентные белки, их отличает широкая полоса поглощения, значительный стоксов сдвиг, узкий спектр излучения и высокий квантовый выход (до 80%), а также высокая фотостабильность [157, 158]. Благодаря выраженной зависимости длины волны излучения от размеров частицы, существует возможность многоцветного мечения и одновременной идентификации различных биологических объектов. Однако следует отметить, что токсичность КТ значительно ограничивает спектр их применений in vivo в терапевтических целях. Гораздо более многообещающим воспринимается применение КТ для картирования сторожевых лимфоузлов, поскольку в данном случае производится местная инъекция препарата с последующим удалением лимфатического центра, пораженного метастазами.
В частности, для диагностических целей использовали квантовые точки QD655, модифицированные анти-HER2-аффибоди ZHER2:477 через систему стрептавидин–биотин. Такие квантовые точки использовали для иммуногистохимического окрашивания срезов образцов опухолей для успешного определения HER2-статуса опухоли, а также наличия и локализации гомодимеров HER2 методами конфокальной и электронной микроскопии [159, 160].
Для визуализации in vivo использовали 5-нм квантовые точки QD800 (ядро/оболочка/оболочка = InAs/InP/ZnSe), которые конъюгировали с анти-HER2-аффибоди ZHER2:342 через гетеробифункциональное производное ПЭГ с концевой аминогруппой. Аффибоди модифицировали цистеином на N-конце и осуществляли реакцию химической конъюгации с использованием N-сукцинимидилового эфира 4-малеимидомасляной кислоты. Анти-HER2 квантовые точки применяли для селективной визуализации SK-OV-3 опухолей у мышей с иммунодефицитом в режиме реального времени с использованием системы прижизненной визуализации [161]. Показано, что накопление адресных квантовых точек в опухоли примерно в 3 раза выше, чем безадресных [161].
На поверхности 8-нм квантовых точек сульфида серебра (Ag2S) адсорбировали анти-EGFR-аффибоди ZEGFR:1907 и применяли модифицированные частицы для фотоакустической визуализации EGFR-сверхэкспрессирующих опухолей [162]. Такие же квантовые точки, покрытые аффибоди, распознающим IGF-1R, ZIGF1R, использовали in vivo для бимодальной фотоакустической и ближней ИК-визуализации опухолей у животных с иммунодефицитом [163].
Широкое применение нашли углеродные точки, которые обладают целым спектром уникальных оптических характеристик. Например, 20-нм углеродные точки Gd@C с инкапсулированным гадолинием обладают не только яркой флуоресценцией, но и свойством МРТ-контрастирования [164]. Такие точки были покрыты анти-EGFR-аффибоди ZEGFR:1907 и использованы для адресной доставки in vitro и in vivo. In vitro показано, что МРТ-сигнал клеток HCC827 (EGFR+) значительно выше, чем клеток NCI-H520 (EGFR). Такие структуры эффективны также для адресной визуализации опухоли in vivo через 1 ч после инъекции (МРТ-сигналы опухолей HCC827 и NCI-H520 различались в 1.5 раза). Кроме того, точки Gd@C с ZEGFR:1907 (в отличие от точек Gd@C) эффективно выводятся почками [164].
5. АДРЕСНЫЕ НАНОЧАСТИЦЫ НА ОСНОВЕ БЕЛКОВ ADAPT
Высокие константы аффинности белков на основе альбуминсвязывающих доменов (ABD, albumin binding domain) ADAPT позволили разработать ультрачувствительный метод обнаружения HER2 в образцах, содержащих 10% сыворотки. Так, получены квантовые точки QD625, которые модифицировали посредством самосборки белком ADAPT6, распознающим HER2. Предел обнаружения HER2 с использованием таких квантовых точек составил 40 × 10−12 М (≈8 нг/мл) [165].
6. ЗАКЛЮЧЕНИЕ
Cкаффолдовые (каркасные) белки можно назвать белками нового поколения [166–169]. Достаточно большое количество препаратов на основе таких белков проходит клинические испытания [170–175], а часть препаратов уже используется в тераностике (например, экаллантид на основе домена Кунитца).
Несмотря на такие преимущества, как малый размер, стабильная структура, легкость масштабной биотехнологической наработки, эти белки при их использовании в комплексе с функциональными наноструктурами имеют и недостатки, связанные, например, с региоселективным присоединением к поверхности наноструктур с сохранением распознающих свойств. Подобные проблемы решаются с использованием различных молекулярных посредников между поверхностью наночастиц и белковых молекул (таких, как SpyTag–SpyCatcher, барназа–барстар, стрептавидин–биотин), а также методов генной инженерии (например, встраивание дарпинов в оболочку вирусов).
Успехи химической модификации и генной инженерии позволяют получать наночастицы, максимально эффективные только in vitro. При системной инъекции в кровоток накопление адресных наночастиц в опухоли чаще всего не более чем в 2.5 раза превышает значение для ненацеленных наночастиц, а суммарное накопление в опухоли не превышает 0.7% от введенной дозы.
Наряду с разработкой адресных агентов для терапии и диагностики онкозаболеваний (а также онкотераностики), создание новых методов введения и доставки наночастиц представляется не менее приоритетным направлением нанобиомедицины, которому на сегодняшний день уделяется гораздо меньше внимания. В частности, разрабатываются методы продления циркуляции наночастиц в кровотоке, которые временно блокируют систему мононуклеаров без серьезных побочных эффектов.
Поскольку солидные опухоли представляют собой плотные гетерогенные структуры, воздействие адресными терапевтическими соединениями на раковые клетки in vivo эффективно только для самых верхних слоев опухоли, в то время как глубинные клетки остаются жизнеспособными, нивелируя таким образом эффект адресного воздействия. Необходимо осуществлять блокировку процессов ангиогенеза (посредством воздействия на эндотелиальные маркеры), нарушая тем самым питание глубоколежащих раковых клеток.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-14-50514.
Об авторах
Виктория Олеговна Шипунова
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Автор, ответственный за переписку.
Email: viktoriya.shipunova@phystech.edu
Россия, 117997, Москва
Сергей Михайлович Деев
Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Email: viktoriya.shipunova@phystech.edu
Россия, 117997, Москва
Список литературы
- Деев С.М., Лебеденко Е.Н. // Биоорг. химия. 2015. Т. 41. № 5. С. 539–552.
- Shilova O.N., Deyev S.M. // Acta Naturae. 2019. V. 11. № 4. P. 42–53.
- Danhier F. // J. Control. Release. 2016. V. 244. № A. P. 108–121.
- Lammers T., Kiessling F., Hennink W.E., Storm G. // J. Control. Release. 2012. V. 161. № 2. P. 175–187.
- Wilhelm S., Tavares A.J., Dai Q., Ohta S., Audet J., Dvorak H.F., Chan W.C.W. // Nat. Rev. Mater. 2016. V. 1. № 5. P. 751.
- Shipunova V.O., Komedchikova E.N., Kotelnikova P.A., Zelepukin I.V., Schulga A.A., Proshkina G.M., Shramova E.I., Kutscher H.L., Telegin G.B., Kabashin A.V., et al. // ACS Nano. 2020. V. 14. № 10. P. 12781–12795.
- Nikitin M.P., Shipunova V.O., Deyev S.M., Nikitin P.I. // Nat. Nanotechnol. 2014. V. 9. № 9. P. 716–722.
- Stepanov A.V., Belogurov A.A., Ponomarenko N.A., Stremovskiy O.A., Kozlov L.V., Bichucher A.M., Dmitriev S.E., Smirnov I.V., Shamborant O.G., Balabashin D.S., et al. // PLoS One. 2011. V. 6. № 6. P. e20991.
- Zelepukin I.V., Yaremenko A.V., Shipunova V.O., Babenyshev A.V., Balalaeva I.V., Nikitin P.I., Deyev S.M., Nikitin M.P. // Nanoscale. 2019. V. 11. № 4. P. 1636–1646.
- Zelepukin I.V., Yaremenko A.V., Ivanov I.N., Yuryev M.V., Cherkasov V.R., Deyev S.M., Nikitin P.I., Nikitin M.P. // ACS Nano. 2021. doi: 10.1021/acsnano.1c00687
- Zelepukin I.V., Yaremenko A.V., Yuryev M.V., Mirkasymov A.B., Sokolov I.L., Deyev S.M., Nikitin P.I., Nikitin M.P. // J. Control. Release. 2020. V. 326. P. 181–191.
- Nikitin M.P., Zelepukin I.V., Shipunova V.O., Sokolov I.L., Deyev S.M., Nikitin P.I. // Nat. Biomed. Eng. 2020. V. 4. № 7. P. 717–731.
- Mirkasymov A.B., Zelepukin I.V., Nikitin P.I., Nikitin M.P., Deyev S.M. // J. Control. Release. 2021. V. 330. P. 111–118.
- Deyev S.M., Lebedenko E.N., Petrovskaya L.E., Dolgikh D.A., Gabibov A.G., Kirpichnikov M.P. // Rus. Chem. Rev. 2015. V. 84. № 1. P. 1–26.
- Tregubov A.A., Sokolov I.L., Babenyshev A.V., Nikitin P.I., Cherkasov V.R., Nikitin M.P. // J. Magn. Magn. Mat. 2018. V. 449. P. 590–596.
- Shipunova V.O., Nikitin M.P., Zelepukin I.V., Nikitin P.I., Deyev S.M., Petrov R.V. // Dokl. Biochem. Biophys. 2015. V. 464. P. 315–318.
- Silverman J., Liu Q., Lu Q., Bakker A., To W., Duguay A., Alba B.M., Smith R., Rivas A., Li P., et al. // Nat. Biotechnol. 2005. V. 23. № 12. P. 1556–1561.
- Nord K., Nilsson J., Nilsson B., Uhlén M., Nygren P.A. // Protein Eng. 1995. V. 8. № 6. P. 601–608.
- Tiede C., Tang A.A.S., Deacon S.E., Mandal U., Nettleship J.E., Owen R.L., George S.E., Harrison D.J., Owens R.J., Tomlinson D.C., et al. // Protein Eng. Des. Sel. 2014. V. 27. № 5. P. 145–155.
- Miller C.J., McGinnis J.E., Martinez M.J., Wang G., Zhou J., Simmons E., Amet T., Abdeen S.J., van Huysse J.W., Bowsher R.R., et al. // New Biotechnol. 2021. V. 62. P. 79–85.
- Sha F., Salzman G., Gupta A., Koide S. // Protein Sci. 2017. V. 26. № 5. P. 910–924.
- Koide A., Bailey C.W., Huang X., Koide S. // J. Mol. Biol. 1998. V. 284. № 4. P. 1141–1151.
- Zelensky A.N., Gready J.E. // FEBS J. 2005. V. 272. № 24. P. 6179–6217.
- Deuschle F.-C., Ilyukhina E., Skerra A. // Expert Opin. Biol. Ther. 2021. V. 21. № 4. P. 509–518.
- Rothe C., Skerra A. // BioDrugs. 2018. V. 32. № 3. P. 233–243.
- Orlova A., Magnusson M., Eriksson T.L.J., Nilsson M., Larsson B., Höidén-Guthenberg I., Widström C., Carlsson J., Tolmachev V., Ståhl S., et al. // Cancer Res. 2006. V. 66. № 8. P. 4339–4348.
- Ebersbach H., Fiedler E., Scheuermann T., Fiedler M., Stubbs M.T., Reimann C., Proetzel G., Rudolph R., Fiedler U. // J. Mol. Biol. 2007. V. 372. № 1. P. 172–185.
- Settele F., Zwarg M., Fiedler S., Koscheinz D., Bosse-Doenecke E. // Methods Mol. Biol. 2018. V. 1701. P. 205–238.
- Kyle S. // Trends Biochem. Sci. 2018. V. 43. № 4. P. 230–232.
- Markland W., Ley A.C., Ladner R.C. // Biochemistry. 1996. V. 35. № 24. P. 8058–8067.
- Krehenbrink M., Chami M., Guilvout I., Alzari P.M., Pécorari F., Pugsley A.P. // J. Mol. Biol. 2008. V. 383. № 5. P. 1058–1068.
- Crook Z.R., Nairn N.W., Olson J.M. // Trends Biochem. Sci. 2020. V. 45. № 4. P. 332–346.
- Huet S., Gorre H., Perrocheau A., Picot J., Cinier M. // PLoS One. 2015. V. 10. № 11. P. e0142304.
- Steiner D., Forrer P., Plückthun A. // J. Mol. Biol. 2008. V. 382. № 5. P. 1211–1227.
- Stefan N., Martin-Killias P., Wyss-Stoeckle S., Honegger A., Zangemeister-Wittke U., Plückthun A. // J. Mol. Biol. 2011. V. 413. № 4. P. 826–843.
- Stahl A., Stumpp M.T., Schlegel A., Ekawardhani S., Lehrling C., Martin G., Gulotti-Georgieva M., Villemagne D., Forrer P., Agostini H.T., et al. // Angiogenesis. 2013. V. 16. № 1. P. 101–111.
- Amstutz P., Koch H., Binz H.K., Deuber S.A., Plückthun A. // Protein Eng. Des. Sel. 2006. V. 19. № 5. P. 219–229.
- Gracy J., Chiche L. // Curr. Pharm. Des. 2011. V. 17. № 38. P. 4337–4350.
- Steemson J.D., Baake M., Rakonjac J., Arcus V.L., Liddament M.T. // PLoS One. 2014. V. 9. № 1. P. e86050.
- Hosse R.J., Rothe A., Power B.E. // Protein Sci. 2006. V. 15. № 1. P. 14–27.
- Škrlec K., Štrukelj B., Berlec A. // Trends Biotechnol. 2015. V. 33. № 7. P. 408–418.
- Lee S.-C., Park K., Han J., Lee J.-j., Kim H.J., Hong S., Heu W., Kim Y.J., Ha J.-S., Lee S.-G., et al. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 9. P. 3299–3304.
- Grabulovski D., Kaspar M., Neri D. // J. Biol. Chem. 2007. V. 282. № 5. P. 3196–3204.
- Diem M.D., Hyun L., Yi F., Hippensteel R., Kuhar E., Lowenstein C., Swift E.J., O’Neil K.T., Jacobs S.A. // Protein Eng. Des. Sel. 2014. V. 27. № 10. P. 419–429.
- Garousi J., Lindbo S., Mitran B., Buijs J., Vorobyeva A., Orlova A., Tolmachev V., Hober S. // Sci. Rep. 2017. V. 7. № 1. P. 14780.
- Suderman R.J., Rice D.A., Gibson S.D., Strick E.J., Chao D.M. // Protein Expr. Purif. 2017. V. 134. P. 114–124.
- Coates J. // Trends Cell Biol. 2003. V. 13. № 9. P. 463–471.
- Schneider S., Buchert M., Georgiev O., Catimel B., Halford M., Stacker S.A., Baechi T., Moelling K., Hovens C.M. // Nat. Biotechnol. 1999. V. 17. № 2. P. 170–175.
- Kim D., Seo H.-D., Ryu Y., Kim H.-S. // Anal. Chim. Acta. 2020. V. 1126. P. 154–162.
- Kim J.-W., Heu W., Jeong S., Kim H.-S. // Anal. Chim. Acta. 2017. V. 988. P. 81–88.
- Lee J.-j., Kang J.A., Ryu Y., Han S.-S., Nam Y.R., Rho J.K., Choi D.S., Kang S.-W., Lee D.-E., Kim H.-S. // Biomaterials. 2017. V. 120. P. 22–31.
- Khaled Y.S., Shamsuddin S., Tiernan J., McPherson M., Hughes T., Millner P., Jayne D.G. // Eur. J. Surg. Oncol. 2018. V. 44. P. S1.
- Gaspar D.P., Faria V., Quintas J.P., Almeida A.J. // Curr. Org. Chem. 2017. V. 21. № 23. P. 2360–2375.
- Resnier P., Lepeltier E., Emina A.L., Galopin N., Bejaud J., David S., Ballet C., Benvegnu T., Pecorari F., Chourpa I., et al. // RSC Adv. 2019. V. 9. № 47. P. 27264–27278.
- Vukojicic P., Béhar G., Tawara M.H., Fernandez-Villamarin M., Pecorari F., Fernandez-Megia E., Mouratou B. // ACS Appl. Mater. Interfaces. 2019. V. 11. № 24. P. 21391–21398.
- Klem R., de Ruiter M.V., Cornelissen J.J.L.M. // Mol. Pharm. 2018. V. 15. № 8. P. 2991–2996.
- Grove T.Z., Cortajarena A.L., Regan L. // Curr. Opin. Struct. Biol. 2008. V. 18. № 4. P. 507–515.
- Gebauer M., Skerra A. // Annu. Rev. Pharmacol. Toxicol. 2020. V. 60. P. 391–415.
- Kobe B., Kajava A.V. // Trends Biochem. Sci. 2000. V. 25. № 10. P. 509–515.
- Grönwall C., Ståhl S. // J. Biotechnol. 2009. V. 140. № 3–4. P. 254–269.
- Zahnd C., Kawe M., Stumpp M.T., de Pasquale C., Tamaskovic R., Nagy-Davidescu G., Dreier B., Schibli R., Binz H.K., Waibel R., et al. // Cancer Res. 2010. V. 70. № 4. P. 1595–1605.
- Binz H.K., Amstutz P., Kohl A., Stumpp M.T., Briand C., Forrer P., Grütter M.G., Plückthun A. // Nat. Biotechnol. 2004. V. 22. № 5. P. 575–582.
- Schilling J., Schöppe J., Plückthun A. // J. Mol. Biol. 2014. V. 426. № 3. P. 691–721.
- Li D.-L., Tan J.-E., Tian Y., Huang S., Sun P.-H., Wang M., Han Y.-J., Li H.-S., Wu H.-B., Zhang X.-M., et al. // Biomaterials. 2017. V. 147. P. 86–98.
- Kotelnikova P.A., Shipunova V.O., Aghayeva U.F., Stremovskiy O.A., Nikitin M.P., Novikov I.A., Schulga A.A., Deyev S.M., Petrov R.V. // Dokl. Biochem. Biophys. 2018. V. 481. № 1. P. 198–200.
- Shipunova V.O., Kolesnikova O.A., Kotelnikova P.A., Soloviev V.D., Popov A.A., Proshkina G.M., Nikitin M.P., Deyev S.M. // ACS Omega. 2021. V. 6. № 24. P. 16000–16008.
- Shipunova V.O., Kotelnikova P.A., Aghayeva U.F., Stremovskiy O.A., Novikov I.A., Schulga A.A., Nikitin M.P., Deyev S.M. // J. Magn. Magn. Mat. 2019. V. 469. P. 450–455.
- Shipunova V.O., Zelepukin I.V., Stremovskiy O.A., Nikitin M.P., Care A., Sunna A., Zvyagin A.V., Deyev S.M. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 20. P. 17437–17447.
- Plückthun A. // Annu. Rev. Pharmacol. Toxicol. 2015. V. 55. P. 489–511.
- Ignatiadis M., van den Eynden G., Roberto S., Fornili M., Bareche Y., Desmedt C., Rothé F., Maetens M., Venet D., Holgado E., et al. // J. Natl. Cancer Inst. 2019. V. 111. № 1. P. 69–77.
- Nahta R., Hung M.-C., Esteva F.J. // Cancer Res. 2004. V. 64. № 7. P. 2343–2346.
- Shipunova V.O., Nikitin M.P., Mironova K.E., Deyev S.M., Nikitin P.I. // IEEE 15th International Conference. Rome, Italy, 2015. Р. 13–16.
- Deyev S.M., Waibel R., Lebedenko E.N., Schubiger A.P., Plückthun A. // Nat. Biotechnol. 2003. V. 21. № 12. P. 1486–1492.
- Sreenivasan V.K.A., Ivukina E.A., Deng W., Kelf T.A., Zdobnova T.A., Lukash S.V., Veryugin B.V., Stremovskiy O.A., Zvyagin A.V., Deyev S.M. // J. Mater. Chem. 2011. V. 21. № 1. P. 65–68.
- Kabashin A.V., Kravets V.G., Wu F., Imaizumi S., Shipunova V.O., Deyev S.M., Grigorenko A.N. // Adv. Funct. Mater. 2019. V. 29. № 26. P. 1902692.
- Zelepukin I.V., Popov A.A., Shipunova V.O., Tikhonowski G.V., Mirkasymov A.B., Popova-Kuznetsova E.A., Klimentov S.M., Kabashin A.V., Deyev S.M. // Mater. Sci. Eng. C. 2021. V. 120. P. 111717.
- Belova M.M., Shipunova V.O., Kotelnikova P.A., Babenyshev A.V., Rogozhin E.A., Cherednichenko M.Y., Deyev S.M. // Acta Naturae. 2019. V. 11. № 2. P. 47–53.
- Zelepukin I.V., Shipunova V.O., Mirkasymov A.B., Nikitin P.I., Nikitin M.P., Deyev S.M. // Acta Naturae. 2017. V. 9. № 4 (35). P. 58–65.
- Deyev S., Proshkina G., Ryabova A., Tavanti F., Menziani M.C., Eidelshtein G., Avishai G., Kotlyar A. // Bioconjugate Chem. 2017. V. 28. № 10. P. 2569–2574.
- Proshkina G., Deyev S., Ryabova A., Tavanti F., Menziani M.C., Cohen R., Katrivas L., Kotlyar A. // ACS Appl. Mater. Interfaces. 2019. V. 11. № 38. P. 34645–34651.
- Grebenik E.A., Kostyuk A.B., Deyev S.M. // Rus. Chem. Rev. 2016. V. 85. № 12. P. 1277–1296.
- Khaydukov E.V., Mironova K.E., Semchishen V.A., Generalova A.N., Nechaev A.V., Khochenkov D.A., Stepanova E.V., Lebedev O.I., Zvyagin A.V., Deyev S.M., et al. // Sci. Rep. 2016. V. 6. P. 35103.
- Guller A.E., Generalova A.N., Petersen E.V., Nechaev A.V., Trusova I.A., Landyshev N.N., Nadort A., Grebenik E.A., Deyev S.M., Shekhter A.B., et al. // Nano Res. 2015. V. 8. № 5. P. 1546–1562.
- Grebenik E.A., Nadort A., Generalova A.N., Nechaev A.V., Sreenivasan V.K.A., Khaydukov E.V., Semchishen V.A., Popov A.P., Sokolov V.I., Akhmanov A.S., et al. // J. Biomed. Opt. 2013. V. 18. № 7. P. 76004.
- Generalova A.N., Kochneva I.K., Khaydukov E.V., Semchishen V.A., Guller A.E., Nechaev A.V., Shekhter A.B., Zubov V.P., Zvyagin A.V., Deyev S.M. // Nanoscale. 2015. V. 7. № 5. P. 1709–1717.
- Guryev E.L., Shilyagina N.Y., Kostyuk A.B., Sencha L.M., Balalaeva I.V., Vodeneev V.A., Kutova O.M., Lyubeshkin A.V., Yakubovskaya R.I., Pankratov A.A., et al. // Toxicol. Sci. 2019. V. 170. № 1. P. 123–132.
- Mironova K.E., Khochenkov D.A., Generalova A.N., Rocheva V.V., Sholina N.V., Nechaev A.V., Semchishen V.A., Deyev S.M., Zvyagin A.V., Khaydukov E.V. // Nanoscale. 2017. V. 9. № 39. P. 14921–14928.
- Guryev E.L., Smyshlyaeva A.S., Shilyagina N.Y., Sokolova E.A., Shanwar S., Kostyuk A.B., Lyubeshkin A.V., Schulga A.A., Konovalova E.V., Lin Q., et al. // Molecules. 2020. V. 25. № 18. P. 4302. doi: 10.3390/molecules25184302.
- Guryev E.L., Smyshlyaeva A.S., Shilyagina N.Y., Shanwar S., Kostyuk A.B., Shulga A.A., Konovalova E.V., Zvyagin A.V., Deyev S.M., Petrov R.V. // Dokl. Biochem. Biophys. 2020. V. 491. № 1. P. 73–76.
- Shapira A., Benhar I. // Toxins (Basel). 2010. V. 2. № 11. P. 2519–2583.
- Liu W., Onda M., Lee B., Kreitman R.J., Hassan R., Xiang L., Pastan I. // Proc. Natl. Acad. Sci. USA. 2012. V. 109. № 29. P. 11782–11787.
- Guryev E.L., Volodina N.O., Shilyagina N.Y., Gudkov S.V., Balalaeva I.V., Volovetskiy A.B., Lyubeshkin A.V., Sen’ A.V., Ermilov S.A., Vodeneev V.A., et al. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 39. P. 9690–9695.
- Shipunova V.O., Shramova E.I., Schulga A.A., Shilova M.V., Deyev S.M., Proshkina G.M. // Rus. J. Bioorg. Chem. 2020. V. 46. № 6. P. 1156–1161.
- Shramova E., Proshkina G., Shipunova V., Ryabova A., Kamyshinsky R., Konevega A., Schulga A., Konovalova E., Telegin G., Deyev S. // Cancers (Basel). 2020. V. 12. № 10. P. 3014. doi: 10.3390/cancers12103014.
- Soysal S.D., Muenst S., Barbie T., Fleming T., Gao F., Spizzo G., Oertli D., Viehl C.T., Obermann E.C., Gillanders W.E. // Br. J. Cancer. 2013. V. 108. № 7. P. 1480–1487.
- Deyev S., Proshkina G., Baryshnikova O., Ryabova A., Avishai G., Katrivas L., Giannini C., Levi-Kalisman Y., Kotlyar A. // Eur. J. Pharm. Biopharm. 2018. V. 130. P. 296–305.
- Limoni S.K., Moghadam M.F., Moazzeni S.M., Gomari H., Salimi F. // Appl. Biochem. Biotechnol. 2019. V. 187. № 1. P. 352–364.
- Münch R.C., Mühlebach M.D., Schaser T., Kneissl S., Jost C., Plückthun A., Cichutek K., Buchholz C.J. // Mol. Ther. 2011. V. 19. № 4. P. 686–693.
- Winkler J., Martin-Killias P., Plückthun A., Zangemeister-Wittke U. // Mol. Cancer Ther. 2009. V. 8. № 9. P. 2674–2683.
- Pala K., Jakimowicz P., Cyranka-Czaja A., Otlewski J. // Mater. Res. Express. 2015. V. 2. № 4. P. 45403.
- Vargo K.B., Zaki A.A., Warden-Rothman R., Tsourkas A., Hammer D.A. // Small. 2015. V. 11. № 12. P. 1409–1413.
- Elias A., Crayton S.H., Warden-Rothman R., Tsourkas A. // Sci. Rep. 2014. V. 4. P. 5840.
- Kolb H.C., Finn M.G., Sharpless K.B. // Angew. Chem. 2001. V. 40. № 11. P. 2004–2021.
- Rostovtsev V.V., Green L.G., Fokin V.V., Sharpless K.B. // Angew. Chem. Int. Ed. 2002. V. 41. № 14. P. 2596–2599.
- Tornøe C.W., Christensen C., Meldal M. // J. Org. Chem. 2002. V. 67. № 9. P. 3057–3064.
- Amirshaghaghi A., Altun B., Nwe K., Yan L., Stein J.M., Cheng Z., Tsourkas A. // J. Am. Chem. Soc. 2018. V. 140. № 42. P. 13550–13553.
- Elias D.R., Cheng Z., Tsourkas A. // Small. 2010. V. 6. № 21. P. 2460–2468.
- Elias D.R., Poloukhtine A., Popik V., Tsourkas A. // Nanomedicine. 2013. V. 9. № 2. P. 194–201.
- Yang M., Cheng K., Qi S., Liu H., Jiang Y., Jiang H., Li J., Chen K., Zhang H., Cheng Z. // Biomaterials. 2013. V. 34. № 11. P. 2796–2806.
- Satpathy M., Zielinski R., Lyakhov I., Yang L. // Methods Mol. Biol. 2015. V. 1219. P. 171–185.
- Satpathy M., Wang L., Zielinski R., Qian W., Lipowska M., Capala J., Lee G.Y., Xu H., Wang Y.A., Mao H., et al. // Small. 2014. V. 10. № 3. P. 544–555.
- Satpathy M., Wang L., Zielinski R.J., Qian W., Wang Y.A., Mohs A.M., Kairdolf B.A., Ji X., Capala J., Lipowska M., et al. // Theranostics. 2019. V. 9. № 3. P. 778–795.
- Liu J., Chen H., Fu Y., Li X., Chen Y., Zhang H., Wang Z. // J. Mater. Chem. B. 2017. V. 5. № 43. P. 8554–8562.
- Jokerst J.V., Miao Z., Zavaleta C., Cheng Z., Gambhir S.S. // Small. 2011. V. 7. № 5. P. 625–633.
- Thakor A.S., Luong R., Paulmurugan R., Lin F.I., Kempen P., Zavaleta C., Chu P., Massoud T.F., Sinclair R., Gambhir S.S. // Sci. Transl. Med. 2011. V. 3. № 79. P. 79ra33.
- Ravalli A., da Rocha C.G., Yamanaka H., Marrazza G. // Bioelectrochemistry. 2015. V. 106. Pt B. P. 268–275.
- Zhang C., Zhang F., Han M., Wang X., Du J., Zhang H., Li W. // Sci. Rep. 2020. V. 10. № 1. P. 22015.
- Pourshohod A., Jamalan M., Zeinali M., Ghanemi M., Kheirollah A. // J. Drug Deliv. Sci. Technol. 2019. V. 52. № 9524. P. 934–941.
- Ju Y., Zhang H., Yu J., Tong S., Tian N., Wang Z., Wang X., Su X., Chu X., Lin J., et al. // ACS Nano. 2017. V. 11. № 9. P. 9239–9248.
- Kwon K.C., Ryu J.H., Lee J.-H., Lee E.J., Kwon I.C., Kim K., Lee J. // Adv. Mat. 2014. V. 26. № 37. P. 6436–6441.
- Lucky S.S., Idris N.M., Huang K., Kim J., Li Z., Thong P.S.P., Xu R., Soo K.C., Zhang Y. // Theranostics. 2016. V. 6. № 11. P. 1844–1865.
- Badieirostami M., Carpenter C., Pratx G., Xing L., Sun C. // MRS Adv. 2019. V. 4. № 46–47. P. 2461–2470.
- He L., Brasino M., Mao C., Cho S., Park W., Goodwin A.P., Cha J.N. // Small. 2017. V. 13. № 24. doi: 10.1002/smll.201700504.
- Akhtari J., Rezayat S.M., Teymouri M., Alavizadeh S.H., Gheybi F., Badiee A., Jaafari M.R. // Int. J. Pharm. 2016. V. 505. № 1–2. P. 89–95.
- Smith B., Lyakhov I., Loomis K., Needle D., Baxa U., Yavlovich A., Capala J., Blumenthal R., Puri A. // J. Control. Release. 2011. V. 153. № 2. P. 187–194.
- Moballegh-Nasery M., Mandegary A., Eslaminejad T., Zeinali M., Pardakhti A., Behnam B., Mohammadi M. // J. Liposome Res. 2021. V. 31. № 2. P. 189–194.
- Alavizadeh S.H., Akhtari J., Badiee A., Golmohammadzadeh S., Jaafari M.R. // Expert Opin. Drug Deliv. 2016. V. 13. № 3. P. 325–336.
- Beuttler J., Rothdiener M., Müller D., Frejd F.Y., Kontermann R.E. // Bioconjugate Chem. 2009. V. 20. № 6. P. 1201–1208.
- Shipunova V.O., Sogomonyan A.S., Zelepukin I.V., Nikitin M.P., Deyev S.M. // Molecules. 2021. V. 26. № 13. P. 3955.
- Alexis F., Basto P., Levy-Nissenbaum E., Radovic-Moreno A.F., Zhang L., Pridgen E., Wang A.Z., Marein S.L., Westerhof K., Molnar L.K., et al. // Chem. Med. Chem. 2008. V. 3. № 12. P. 1839–1843.
- Narsireddy A., Vijayashree K., Adimoolam M.G., Manorama S.V., Rao N.M. // Int. J. Nanomedicine. 2015. V. 10. P. 6865–6878.
- Feng G., Fang Y., Liu J., Geng J., Ding D., Liu B. // Small. 2017. V. 13. № 3. doi: 10.1002/smll.201602807.
- Liu J., Feng G., Ding D., Liu B. // Polym. Chem. 2013. V. 4. № 16. P. 4326.
- Pu K.-Y., Shi J., Cai L., Li K., Liu B. // Biomacromolecules. 2011. V. 12. № 8. P. 2966–2974.
- Du J., Li X.-Y., Hu H., Xu L., Yang S.-P., Li F.-H. // Sci. Rep. 2018. V. 8. № 1. P. 3887.
- Yang H., Cai W., Xu L., Lv X., Qiao Y., Li P., Wu H., Yang Y., Zhang L., Duan Y. // Biomaterials. 2015. V. 37. P. 279–288.
- Reuter K.G., Perry J.L., Kim D., Luft J.C., Liu R., DeSimone J.M. // Nano Lett. 2015. V. 15. № 10. P. 6371–6378.
- Lee C., Kang S. // Biomacromolecules. 2021. V. 22. № 6. P. 2649–2658.
- Choi H., Eom S., Kim H.-U., Bae Y., Jung H.S., Kang S. // Biomacromolecules. 2021. V. 22. № 7. P. 3028–3039.
- Bae Y., Kim G.J., Kim H., Park S.G., Jung H.S., Kang S. // Biomacromolecules. 2018. V. 19. № 7. P. 2896–2904.
- Kim H., Jin S., Choi H., Kang M., Park S.G., Jun H., Cho H., Kang S. // J. Control. Release. 2021. V. 335. P. 269–280.
- Kim S.-E., Jo S.D., Kwon K.C., Won Y.-Y., Lee J. // Adv. Sci. 2017. V. 4. № 5. P. 1600471.
- Nishimura Y., Mimura W., Mohamed Suffian I.F., Amino T., Ishii J., Ogino C., Kondo A. // J. Biochem. 2013. V. 153. № 3. P. 251–256.
- Nishimura Y., Ishii J., Okazaki F., Ogino C., Kondo A. // J. Drug Target. 2012. V. 20. № 10. P. 897–905.
- Nishimura Y., Ezawa R., Ishii J., Ogino C., Kondo A. // Bioorg. Med. Chem. Lett. 2017. V. 27. № 2. P. 336–341.
- Nishimura Y., Takeda K., Ezawa R., Ishii J., Ogino C., Kondo A. // J. Nanobiotechnology. 2014. V. 12. P. 11.
- Nishimura Y., Mieda H., Ishii J., Ogino C., Fujiwara T., Kondo A. // J. Nanobiotechnology. 2013. V. 11. P. 19.
- Shishido T., Mieda H., Hwang S.Y., Nishimura Y., Tanaka T., Ogino C., Fukuda H., Kondo A. // Bioorg. Med. Chem. Lett. 2010. V. 20. № 19. P. 5726–5731.
- Kwon K.C., Ko H.K., Lee J., Lee E.J., Kim K., Lee J. // Small. 2016. V. 12. № 31. P. 4241–4253.
- Lee N.K., Lee E.J., Kim S., Nam G.-H., Kih M., Hong Y., Jeong C., Yang Y., Byun Y., Kim I.-S. // J. Control. Release. 2017. V. 267. P. 172–180.
- Oh J.Y., Kim H.S., Palanikumar L., Go E.M., Jana B., Park S.A., Kim H.Y., Kim K., Seo J.K., Kwak S.K., et al. // Nat. Commun. 2018. V. 9. № 1. P. 4548.
- Joubran S., Zigler M., Pessah N., Klein S., Shir A., Edinger N., Sagalov A., Razvag Y., Reches M., Levitzki A. // Bioconjugate Chem. 2014. V. 25. № 9. P. 1644–1654.
- Zhang Y., Jiang S., Zhang D., Bai X., Hecht S.M., Chen S. // Chem. Comm. 2017. V. 53. № 3. P. 573–576.
- Zhang C., Zhang H., Han M., Yang X., Pei C., Xu Z., Du J., Li W., Chen S. // RSC Adv. 2019. V. 9. № 4. P. 1982–1989.
- Zhang F., Yin J., Zhang C., Han M., Wang X., Fu S., Du J., Zhang H., Li W. // Macromol. Biosci. 2020. V. 20. № 7. P. e2000083.
- Zhang C., Han M., Zhang F., Yang X., Du J., Zhang H., Li W., Chen S. // Int. J. Nanomedicine. 2020. V. 15. P. 885–900.
- Balalaeva I.V., Zdobnova T.A., Krutova I.V., Brilkina A.A., Lebedenko E.N., Deyev S.M. // J. Biophotonics. 2012. V. 5. № 11–12. P. 860–867.
- Generalova A.N., Sizova S.V., Zdobnova T.A., Zarifullina M.M., Artemyev M.V., Baranov A.V., Oleinikov V.A., Zubov V.P., Deyev S.M. // Nanomedicine. 2011. V. 6. № 2. P. 195–209.
- Peckys D.B., Hirsch D., Gaiser T., de Jonge N. // Mol. Med. 2019. V. 25. № 1. P. 42.
- Peckys D.B., Korf U., de Jonge N. // Sci. Adv. 2015. V. 1. № 6. P. e1500165.
- Gao J., Chen K., Miao Z., Ren G., Chen X., Gambhir S.S., Cheng Z. // Biomaterials. 2011. V. 32. № 8. P. 2141–2148.
- Zhang Y., Zhao N., Qin Y., Wu F., Xu Z., Lan T., Cheng Z., Zhao P., Liu H. // Nanoscale. 2018. V. 10. № 35. P. 16581–16590.
- Sun R., Zhao Y., Wang Y., Zhang Q., Zhao P. // Nanotechnology. 2021. V. 32. № 20. P. 205103.
- Wu Y., Li H., Yan Y., Wang K., Cheng Y., Li Y., Zhu X., Xie J., Sun X. // Int. J. Nanomedicine. 2020. V. 15. P. 4691–4703.
- Wu Y.-T., Qiu X., Lindbo S., Susumu K., Medintz I.L., Hober S., Hildebrandt N. // Small. 2018. V. 14. № 35. P. e1802266.
- Binz H.K., Plückthun A. // Curr. Opin. Biotechnol. 2005. V. 16. № 4. P. 459–469.
- Löfblom J., Frejd F.Y., Ståhl S. // Curr. Opin. Biotechnol. 2011. V. 22. № 6. P. 843–848.
- Martin H.L., Bedford R., Heseltine S.J., Tang A.A., Haza K.Z., Rao A., McPherson M.J., Tomlinson D.C. // New Biotechnol. 2018. V. 45. P. 28–35.
- Nygren P.-A., Skerra A. // J. Immunol. Methods. 2004. V. 290. № 1–2. P. 3–28.
- Renders L., Budde K., Rosenberger C., van Swelm R., Swinkels D., Dellanna F., Feuerer W., Wen M., Erley C., Bader B., et al. // PLoS One. 2019. V. 14. № 3. P. e0212023.
- Mross K., Richly H., Fischer R., Scharr D., Büchert M., Stern A., Gille H., Audoly L.P., Scheulen M.E. // PLoS One. 2013. V. 8. № 12. P. e83232.
- Bragina O., von Witting E., Garousi J., Zelchan R., Sandström M., Orlova A., Medvedeva A., Doroshenko A., Vorobyeva A., Lindbo S., et al. // J. Nucl. Med. 2021. V. 62. № 4. P. 493–499.
- Tolcher A.W., Sweeney C.J., Papadopoulos K., Patnaik A., Chiorean E.G., Mita A.C., Sankhala K., Furfine E., Gokemeijer J., Iacono L., et al. // Clin. Cancer Res. 2011. V. 17. № 2. P. 363–371.
- Sandström M., Lindskog K., Velikyan I., Wennborg A., Feldwisch J., Sandberg D., Tolmachev V., Orlova A., Sörensen J., Carlsson J., et al. // J. Nucl. Med. 2016. V. 57. № 6. P. 867–871.
- Sörensen J., Velikyan I., Sandberg D., Wennborg A., Feldwisch J., Tolmachev V., Orlova A., Sandström M., Lubberink M., Olofsson H., et al. // Theranostics. 2016. V. 6. № 2. P. 262–271.
Дополнительные файлы